+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Trimeric HSV-1F gB ectodomain in postfusion conformation with three bound HDIT102 Fab molecules. | |||||||||
 マップデータ マップデータ | final sharpened map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ectodomain / post-fusion / fab molecule / trimeric / VIRAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報host cell Golgi membrane / host cell endosome membrane / symbiont entry into host cell / viral envelope / virion attachment to host cell / host cell plasma membrane / virion membrane / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /   Human alphaherpesvirus 1 (ヘルペスウイルス) Human alphaherpesvirus 1 (ヘルペスウイルス) | |||||||||
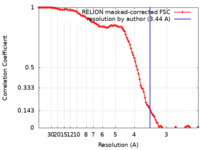
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.44 Å | |||||||||
 データ登録者 データ登録者 | Kalbermatter D / Seyfizadeh N / Imhof T / Ries M / Mueller C / Jenner L / Blumenschein E / Yendrzheyevskiy A / Moog K / Eckert D ...Kalbermatter D / Seyfizadeh N / Imhof T / Ries M / Mueller C / Jenner L / Blumenschein E / Yendrzheyevskiy A / Moog K / Eckert D / Engel R / Diebolder P / Chami M / Krauss J / Schaller T / Arndt M | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: J Biomed Sci / 年: 2024 ジャーナル: J Biomed Sci / 年: 2024タイトル: Development of a highly effective combination monoclonal antibody therapy against Herpes simplex virus. 著者: Narges Seyfizadeh / David Kalbermatter / Thomas Imhof / Moritz Ries / Christian Müller / Leonie Jenner / Elisabeth Blumenschein / Alexandra Yendrzheyevskiy / Frank Grün / Kevin Moog / ...著者: Narges Seyfizadeh / David Kalbermatter / Thomas Imhof / Moritz Ries / Christian Müller / Leonie Jenner / Elisabeth Blumenschein / Alexandra Yendrzheyevskiy / Frank Grün / Kevin Moog / Daniel Eckert / Ronja Engel / Philipp Diebolder / Mohamed Chami / Jürgen Krauss / Torsten Schaller / Michaela Arndt /   要旨: BACKGROUND: Infections with Herpes simplex virus (HSV)-1 or -2 usually present as mild chronic recurrent disease, however in rare cases can result in life-threatening conditions with a large spectrum ...BACKGROUND: Infections with Herpes simplex virus (HSV)-1 or -2 usually present as mild chronic recurrent disease, however in rare cases can result in life-threatening conditions with a large spectrum of pathology. Monoclonal antibody therapy has great potential especially to treat infections with virus resistant to standard therapies. HDIT101, a humanized IgG targeting HSV-1/2 gB was previously investigated in phase 2 clinical trials. The aim of this study was to develop a next-generation therapy by combining different antiviral monoclonal antibodies. 手法: A lymph-node derived phage display library (LYNDAL) was screened against recombinant gB from Herpes simplex virus (HSV) -1 and HDIT102 scFv was selected for its binding characteristics using ...手法: A lymph-node derived phage display library (LYNDAL) was screened against recombinant gB from Herpes simplex virus (HSV) -1 and HDIT102 scFv was selected for its binding characteristics using bio-layer interferometry. HDIT102 was further developed as fully human IgG and tested alone or in combination with HDIT101, a clinically tested humanized anti-HSV IgG, in vitro and in vivo. T-cell stimulating activities by antigen-presenting cells treated with IgG-HSV immune complexes were analyzed using primary human cells. To determine the epitopes, the cryo-EM structures of HDIT101 or HDIT102 Fab bound to HSV-1F as well as HSV-2G gB protein were solved at resolutions < 3.5 Å. RESULTS: HDIT102 Fab showed strong binding to HSV-1F gB with Kd of 8.95 × 10 M and to HSV-2G gB with Kd of 3.29 × 10 M. Neutralization of cell-free virus and inhibition of cell-to-cell ...RESULTS: HDIT102 Fab showed strong binding to HSV-1F gB with Kd of 8.95 × 10 M and to HSV-2G gB with Kd of 3.29 × 10 M. Neutralization of cell-free virus and inhibition of cell-to-cell spread were comparable between HDIT101 and HDIT102. Both antibodies induced internalization of gB from the cell surface into acidic endosomes by binding distinct epitopes in domain I of gB and compete for binding. CryoEM analyses revealed the ability to form heterogenic immune complexes consisting of two HDIT102 and one HDIT101 Fab bound to one gB trimeric molecule. Both antibodies mediated antibody-dependent phagocytosis by antigen presenting cells which stimulated autologous T-cell activation. In vivo, the combination of HDIT101 and HDIT102 demonstrated synergistic effects on survival and clinical outcome in immunocompetent BALB/cOlaHsd mice. CONCLUSION: This biochemical and immunological study showcases the potential of an effective combination therapy with two monoclonal anti-gB IgGs for the treatment of HSV-1/2 induced disease conditions. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_19164.map.gz emd_19164.map.gz | 9.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-19164-v30.xml emd-19164-v30.xml emd-19164.xml emd-19164.xml | 22 KB 22 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_19164_fsc.xml emd_19164_fsc.xml | 10.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_19164.png emd_19164.png | 47.6 KB | ||
| マスクデータ |  emd_19164_msk_1.map emd_19164_msk_1.map | 103 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-19164.cif.gz emd-19164.cif.gz | 7.1 KB | ||
| その他 |  emd_19164_half_map_1.map.gz emd_19164_half_map_1.map.gz emd_19164_half_map_2.map.gz emd_19164_half_map_2.map.gz | 81 MB 80.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-19164 http://ftp.pdbj.org/pub/emdb/structures/EMD-19164 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19164 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19164 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_19164_validation.pdf.gz emd_19164_validation.pdf.gz | 808.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_19164_full_validation.pdf.gz emd_19164_full_validation.pdf.gz | 808.2 KB | 表示 | |
| XML形式データ |  emd_19164_validation.xml.gz emd_19164_validation.xml.gz | 17.9 KB | 表示 | |
| CIF形式データ |  emd_19164_validation.cif.gz emd_19164_validation.cif.gz | 23.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19164 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19164 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19164 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19164 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_19164.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_19164.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | final sharpened map | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.2028 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_19164_msk_1.map emd_19164_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: half map 2
| ファイル | emd_19164_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: half map 1
| ファイル | emd_19164_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Trimeric HSV-1F gB ectodomain in post-fusion conformation with th...
| 全体 | 名称: Trimeric HSV-1F gB ectodomain in post-fusion conformation with three bound HDIT102 Fab molecules |
|---|---|
| 要素 |
|
-超分子 #1: Trimeric HSV-1F gB ectodomain in post-fusion conformation with th...
| 超分子 | 名称: Trimeric HSV-1F gB ectodomain in post-fusion conformation with three bound HDIT102 Fab molecules タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 523 KDa |
-分子 #1: Envelope glycoprotein B
| 分子 | 名称: Envelope glycoprotein B / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Human alphaherpesvirus 1 (ヘルペスウイルス) Human alphaherpesvirus 1 (ヘルペスウイルス) |
| 分子量 | 理論値: 100.449375 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MRQGAPARGC RWFVVWALLG LTLGVLVASA APSSPGTPGV AAATQAANGG PATPAPPAPG PAPTGDTKPK KNKKPKNPPP PRPAGDNAT VAAGHATLRE HLRDIKAENT DANFYVCPPP TGATVVQFEQ PRRCPTRPEG QNYTEGIAVV FKENIAPYKF K ATMYYKDV ...文字列: MRQGAPARGC RWFVVWALLG LTLGVLVASA APSSPGTPGV AAATQAANGG PATPAPPAPG PAPTGDTKPK KNKKPKNPPP PRPAGDNAT VAAGHATLRE HLRDIKAENT DANFYVCPPP TGATVVQFEQ PRRCPTRPEG QNYTEGIAVV FKENIAPYKF K ATMYYKDV TVSQVWFGHR YSQFMGIFED RAPVPFEEVI DKINAKGVCR STAKYVRNNL ETTAFHRDDH ETDMELKPAN AA TRTSRGW HTTDLKYNPS RVEAFHRYGT TVNCIVEEVD ARSVYPYDEF VLATGDFVYM SPFYGYREGS HTEHTSYAAD RFK QVDGFY ARDLTTKARA TAPTTRNLLT TPKFTVAWDW VPKRPSVCTM TKWQEVDEML RSEYGGSFRF SSDAISTTFT TNLT EYPLS RVDLGDCIGK DARDAMDRIF ARRYNATHIK VGQPQYYLAN GGFLIAYQPL LSNTLAELYV REHLREQSRK PPNPT PPPP GASANASVER IKTTSSIEFA RLQFTYNHIQ RHVNDMLGRV AIAWCELQNH ELTLWNEARK LNPNAIASAT VGRRVS ARM LGDVMAVSTC VPVAADNVIV QNSMRISSRP GACYSRPLVS FRYEDQGPLV EGQLGENNEL RLTRDAIEPC TVGHRRY FT FGGGYVYFEE YAYSHQLSRA DITTVSTFID LNITMLEDHE FVPLEVYTRH EIKDSGLLDY TEVQRRNQLH DLRFADID T VIHADANAAM FAGLGAFFEG MGDLGRAVGK VVMGIVGGVV SAVSGVSSFM SNPFGALAVG LLVLAGLAAA FFAFRYVMR LQSNPMKALY PLTTKELKNP TNPDASGEGE EGGDFDEAKL AEAREMIRYM ALVSAMEHTE HKAKKKGTSA LLSAKVTDMV MRKRRNTNY TQVPNKDGDA DEDDLAA UniProtKB: Envelope glycoprotein B |
-分子 #2: HDIT102 Fab heavy chain
| 分子 | 名称: HDIT102 Fab heavy chain / タイプ: protein_or_peptide / ID: 2 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 49.310387 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: EVQLVQSGAE VKTPGASVRV SCKASGHTFR TFDINWVRQA AGQGLEWMGW MSPNSGNTGY ARQFQGRVTM TRNISANTAY MELRGLRFD DTAVYYCARG PGSTGTTGSM DVWGQGTTVT VSSASTKGPS VFPLAPSSKS TSGGTAALGC LVKDYFPEPV T VSWNSGAL ...文字列: EVQLVQSGAE VKTPGASVRV SCKASGHTFR TFDINWVRQA AGQGLEWMGW MSPNSGNTGY ARQFQGRVTM TRNISANTAY MELRGLRFD DTAVYYCARG PGSTGTTGSM DVWGQGTTVT VSSASTKGPS VFPLAPSSKS TSGGTAALGC LVKDYFPEPV T VSWNSGAL TSGVHTFPAV LQSSGLYSLS SVVTVPSSSL GTQTYICNVN HKPSNTKVDK KVEPKSCDKT HTCPPCPAPE LL GGPSVFL FPPKPKDTLM ISRTPEVTCV VVDVSHEDPE VKFNWYVDGV EVHNAKTKPR EEQYNSTYRV VSVLTVLHQD WLN GKEYKC KVSNKALPAP IEKTISKAKG QPREPQVYTL PPSRDELTKN QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTP PVLDS DGSFFLYSKL TVDKSRWQQG NVFSCSVMHE ALHNHYTQKS LSLSPGK |
-分子 #3: HDIT102 Fab heavy chain
| 分子 | 名称: HDIT102 Fab heavy chain / タイプ: protein_or_peptide / ID: 3 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 22.403775 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: QAGLTQPPSV SVAPGKTARI SCGGNNIGSK SVHWYQQKPG QAPVLVIYYD SDRPSGIPER FSGSNSGNTA TLTISRVEAG DEADYYCQV WDSGSVVFGG GTKLTVLGQP KAAPSVTLFP PSSEELQANK ATLVCLISDF YPGAVTVAWK ADSSPVKAGV E TTTPSKQS ...文字列: QAGLTQPPSV SVAPGKTARI SCGGNNIGSK SVHWYQQKPG QAPVLVIYYD SDRPSGIPER FSGSNSGNTA TLTISRVEAG DEADYYCQV WDSGSVVFGG GTKLTVLGQP KAAPSVTLFP PSSEELQANK ATLVCLISDF YPGAVTVAWK ADSSPVKAGV E TTTPSKQS NNKYAASSYL SLTPEQWKSH RSYSCQVTHE GSTVEKTVAP TECS |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 構成要素:
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 85 % / チャンバー内温度: 283.15 K / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 6611 / 平均露光時間: 4.0 sec. / 平均電子線量: 1.15 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー











 Z
Z Y
Y X
X