+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Rho P167L-ATPgS-Psu complex I | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Transcription termination / Phage inhibitor / GENE REGULATION | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報symbiont-mediated activation of host transcription / ATP-dependent activity, acting on RNA / helicase activity / DNA-templated transcription termination / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / ATP hydrolysis activity / RNA binding / ATP binding / identical protein binding / membrane / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |   Enterobacteria phage P4 (ファージ) Enterobacteria phage P4 (ファージ) | |||||||||
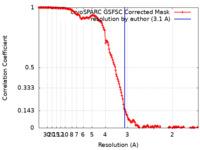
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Gjorgjevikj D / Wahl MC / Hilal T / Loll B | |||||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| |||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: Rho P167L-ATPgS-Psu complex I 著者: Gjorgjevikj D / Wahl MC / Hilal T / Loll B | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_17640.map.gz emd_17640.map.gz | 81.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-17640-v30.xml emd-17640-v30.xml emd-17640.xml emd-17640.xml | 19.3 KB 19.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_17640_fsc.xml emd_17640_fsc.xml | 14.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_17640.png emd_17640.png | 96.3 KB | ||
| Filedesc metadata |  emd-17640.cif.gz emd-17640.cif.gz | 6.4 KB | ||
| その他 |  emd_17640_half_map_1.map.gz emd_17640_half_map_1.map.gz emd_17640_half_map_2.map.gz emd_17640_half_map_2.map.gz | 318.7 MB 318.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-17640 http://ftp.pdbj.org/pub/emdb/structures/EMD-17640 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17640 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17640 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_17640_validation.pdf.gz emd_17640_validation.pdf.gz | 989.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_17640_full_validation.pdf.gz emd_17640_full_validation.pdf.gz | 988.8 KB | 表示 | |
| XML形式データ |  emd_17640_validation.xml.gz emd_17640_validation.xml.gz | 24 KB | 表示 | |
| CIF形式データ |  emd_17640_validation.cif.gz emd_17640_validation.cif.gz | 31.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17640 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17640 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17640 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17640 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8pexMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_17640.map.gz / 形式: CCP4 / 大きさ: 343 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_17640.map.gz / 形式: CCP4 / 大きさ: 343 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.832 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_17640_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
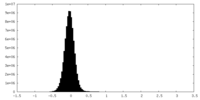
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_17640_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
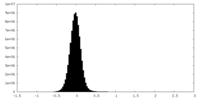
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex of E. coli transcription termination factor Rho P167L var...
| 全体 | 名称: Complex of E. coli transcription termination factor Rho P167L variant with the ATP analog, ATPgammaS and P4 polarity suppression protein Psu |
|---|---|
| 要素 |
|
-超分子 #1: Complex of E. coli transcription termination factor Rho P167L var...
| 超分子 | 名称: Complex of E. coli transcription termination factor Rho P167L variant with the ATP analog, ATPgammaS and P4 polarity suppression protein Psu タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #2 |
|---|
-超分子 #2: Transcription termination factor Rho
| 超分子 | 名称: Transcription termination factor Rho / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  |
-超分子 #3: Polarity suppression protein
| 超分子 | 名称: Polarity suppression protein / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 |
|---|---|
| 由来(天然) | 生物種:  Enterobacteria phage P4 (ファージ) Enterobacteria phage P4 (ファージ) |
-分子 #1: Transcription termination factor Rho
| 分子 | 名称: Transcription termination factor Rho / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 47.086211 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MNLTELKNTP VSELITLGEN MGLENLARMR KQDIIFAILK QHAKSGEDIF GDGVLEILQD GFGFLRSADS SYLAGPDDIY VSPSQIRRF NLRTGDTISG KIRPPKEGER YFALLKVNEV NFDKPENARN KILFENLTPL HANSRLRMER GNGSTEDLTA R VLDLASLI ...文字列: MNLTELKNTP VSELITLGEN MGLENLARMR KQDIIFAILK QHAKSGEDIF GDGVLEILQD GFGFLRSADS SYLAGPDDIY VSPSQIRRF NLRTGDTISG KIRPPKEGER YFALLKVNEV NFDKPENARN KILFENLTPL HANSRLRMER GNGSTEDLTA R VLDLASLI GRGQRGLIVA PPKAGKTMLL QNIAQSIAYN HPDCVLMVLL IDERPEEVTE MQRLVKGEVV ASTFDEPASR HV QVAEMVI EKAKRLVEHK KDVIILLDSI TRLARAYNTV VPASGKVLTG GVDANALHRP KRFFGAARNV EEGGSLTIIA TAL IDTGSK MDEVIYEEFK GTGNMELHLS RKIAEKRVFP AIDYNRSGTR KEELLTTQEE LQKMWILRKI IHPMGEIDAM EFLI NKLAM TKTNDDFFEM MKRS UniProtKB: Transcription termination factor Rho |
-分子 #2: Polarity suppression protein
| 分子 | 名称: Polarity suppression protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 10 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Enterobacteria phage P4 (ファージ) Enterobacteria phage P4 (ファージ) |
| 分子量 | 理論値: 21.393064 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MESTALQQAF DTCQNNKAAW LQRKNELAAA EQEYLRLLSG EGRNVSRLDE LRNIIEVRKW QVNQAAGRYI RSHEAVQHIS IRDRLNDFM QQHGTALAAA LAPELMGYSE LTAIARNCAI QRATDALREA LLSWLAKGEK INYSAQDSDI LTTIGFRPDV A SVDDSREK ...文字列: MESTALQQAF DTCQNNKAAW LQRKNELAAA EQEYLRLLSG EGRNVSRLDE LRNIIEVRKW QVNQAAGRYI RSHEAVQHIS IRDRLNDFM QQHGTALAAA LAPELMGYSE LTAIARNCAI QRATDALREA LLSWLAKGEK INYSAQDSDI LTTIGFRPDV A SVDDSREK FTPAQNMIFS RKSAQLASRQ SV UniProtKB: Polarity suppression protein |
-分子 #3: PHOSPHOTHIOPHOSPHORIC ACID-ADENYLATE ESTER
| 分子 | 名称: PHOSPHOTHIOPHOSPHORIC ACID-ADENYLATE ESTER / タイプ: ligand / ID: 3 / コピー数: 12 / 式: AGS |
|---|---|
| 分子量 | 理論値: 523.247 Da |
| Chemical component information |  ChemComp-AGS: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 12 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| 凍結 | 凍結剤: NITROGEN / チャンバー内湿度: 100 % / チャンバー内温度: 283 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 2766 / 平均露光時間: 40.57 sec. / 平均電子線量: 42.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.9 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||
|---|---|---|---|---|---|---|---|
| 詳細 | Crystal structures of Rho (PDB ID: 1PV4) and Psu (PDB ID: 3RX6) were manually placed in the cryoEM reconstructions and each protomer was adjusted by rigid body fitting and segmental real-space refinement using Coot (version 0.9.6). The model was refined by iterative rounds of real space refinement in PHENIX (version 1.20_4459) and manual adjustment in Coot. | ||||||
| 精密化 | 空間: REAL 当てはまり具合の基準: Cross-correlation coefficient | ||||||
| 得られたモデル |  PDB-8pex: |
 ムービー
ムービー コントローラー
コントローラー








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)