+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | 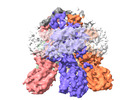 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | VaPomAB MSP1D1 nanodisc | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Flagellar sodium-driven stator unit / MOTOR PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報bacterial-type flagellum-dependent swarming motility / proton transmembrane transport / chemotaxis / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Vibrio alginolyticus (バクテリア) Vibrio alginolyticus (バクテリア) | ||||||||||||
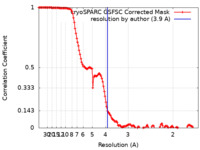
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.9 Å | ||||||||||||
 データ登録者 データ登録者 | Haidai H / Nicholas MIT | ||||||||||||
| 資金援助 |  デンマーク, 3件 デンマーク, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Ion selectivity and rotor coupling of the Vibrio flagellar sodium-driven stator unit. 著者: Haidai Hu / Philipp F Popp / Mònica Santiveri / Aritz Roa-Eguiara / Yumeng Yan / Freddie J O Martin / Zheyi Liu / Navish Wadhwa / Yong Wang / Marc Erhardt / Nicholas M I Taylor /     要旨: Bacteria swim using a flagellar motor that is powered by stator units. Vibrio spp. are highly motile bacteria responsible for various human diseases, the polar flagella of which are exclusively ...Bacteria swim using a flagellar motor that is powered by stator units. Vibrio spp. are highly motile bacteria responsible for various human diseases, the polar flagella of which are exclusively driven by sodium-dependent stator units (PomAB). However, how ion selectivity is attained, how ion transport triggers the directional rotation of the stator unit, and how the stator unit is incorporated into the flagellar rotor remained largely unclear. Here, we have determined by cryo-electron microscopy the structure of Vibrio PomAB. The electrostatic potential map uncovers sodium binding sites, which together with functional experiments and molecular dynamics simulations, reveal a mechanism for ion translocation and selectivity. Bulky hydrophobic residues from PomA prime PomA for clockwise rotation. We propose that a dynamic helical motif in PomA regulates the distance between PomA subunit cytoplasmic domains, stator unit activation, and torque transmission. Together, our study provides mechanistic insights for understanding ion selectivity and rotor incorporation of the stator unit of the bacterial flagellum. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
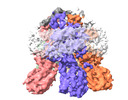
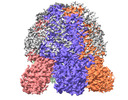
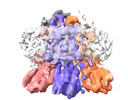
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16215.map.gz emd_16215.map.gz | 230.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16215-v30.xml emd-16215-v30.xml emd-16215.xml emd-16215.xml | 15.2 KB 15.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16215_fsc.xml emd_16215_fsc.xml | 13.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16215.png emd_16215.png | 116.6 KB | ||
| Filedesc metadata |  emd-16215.cif.gz emd-16215.cif.gz | 5.5 KB | ||
| その他 |  emd_16215_half_map_1.map.gz emd_16215_half_map_1.map.gz emd_16215_half_map_2.map.gz emd_16215_half_map_2.map.gz | 226.9 MB 226.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16215 http://ftp.pdbj.org/pub/emdb/structures/EMD-16215 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16215 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16215 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16215_validation.pdf.gz emd_16215_validation.pdf.gz | 913.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16215_full_validation.pdf.gz emd_16215_full_validation.pdf.gz | 912.8 KB | 表示 | |
| XML形式データ |  emd_16215_validation.xml.gz emd_16215_validation.xml.gz | 21.6 KB | 表示 | |
| CIF形式データ |  emd_16215_validation.cif.gz emd_16215_validation.cif.gz | 27.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16215 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16215 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16215 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16215 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16215.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16215.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.832 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_16215_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_16215_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : flagellar sodium-driven stator unit
| 全体 | 名称: flagellar sodium-driven stator unit |
|---|---|
| 要素 |
|
-超分子 #1: flagellar sodium-driven stator unit
| 超分子 | 名称: flagellar sodium-driven stator unit / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Vibrio alginolyticus (バクテリア) Vibrio alginolyticus (バクテリア) |
-分子 #1: Chemotaxis protein PomA
| 分子 | 名称: Chemotaxis protein PomA / タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Vibrio alginolyticus (バクテリア) Vibrio alginolyticus (バクテリア) |
| 分子量 | 理論値: 27.283031 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDLATLLGLI GGFAFVIMAM VLGGSIGMFV DVTSILIVVG GSIFVVLMKF TMGQFFGATK IAGKAFMFKA DEPEDLIAKI VEMADAARK GGFLALEEME INNTFMQKGI DLLVDGHDAD VVRAALKKDI ALTDERHTQG TGVFRAFGDV APAMGMIGTL V GLVAMLSN ...文字列: MDLATLLGLI GGFAFVIMAM VLGGSIGMFV DVTSILIVVG GSIFVVLMKF TMGQFFGATK IAGKAFMFKA DEPEDLIAKI VEMADAARK GGFLALEEME INNTFMQKGI DLLVDGHDAD VVRAALKKDI ALTDERHTQG TGVFRAFGDV APAMGMIGTL V GLVAMLSN MDDPKAIGPA MAVALLTTLY GAILSNMVFF PIADKLSLRR DQETLNRRLI MDGVLAIQDG QNPRVIDSYL KN YLNEGKR ALEIDE UniProtKB: Chemotaxis protein PomA |
-分子 #2: Flagellar motor protein
| 分子 | 名称: Flagellar motor protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Vibrio alginolyticus (バクテリア) Vibrio alginolyticus (バクテリア) |
| 分子量 | 理論値: 35.587254 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDDEDNKCDC PPPGLPLWMG TFADLMSLLM CFFVLLLSFS EMDVLKFKQI AGSMKFAFGV QNQLEVKDIP KGTSIIAQEF RPGRPEPTP IDVIMQQTMD ITQQTLEFHE GESERAGGTK RDEGKLTGGQ SPETSTQNNE SAEADMQQQQ SKEMSQEMET L MESIKKAL ...文字列: MDDEDNKCDC PPPGLPLWMG TFADLMSLLM CFFVLLLSFS EMDVLKFKQI AGSMKFAFGV QNQLEVKDIP KGTSIIAQEF RPGRPEPTP IDVIMQQTMD ITQQTLEFHE GESERAGGTK RDEGKLTGGQ SPETSTQNNE SAEADMQQQQ SKEMSQEMET L MESIKKAL EREIEQGAIE VENLGQQIVI RMREKGAFPE GSAFLQPKFR PLVRQIAELV KDVPGIVRVS GHTDNRPLDS EL YRSNWDL SSQRAVSVAQ EMEKVRGFSH QRLRVRGMAD TEPLLPNDSD ENRALNRRVE ISIMQGEPLY SEEVPVIQ UniProtKB: Flagellar motor protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 16 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 / 詳細: 300mM NaCl, 20mM HEPES 7.5, 0.002%LMNG |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 平均電子線量: 38.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





 Z
Z Y
Y X
X