+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human NEXT dimer - overall reconstruction of the core complex | |||||||||||||||
 マップデータ マップデータ | NEXT_S_overall_reconstruction_postprocessed | |||||||||||||||
 試料 試料 |
| |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / snRNA catabolic process / TRAMP complex / RNA catabolic process / maturation of 5.8S rRNA / Major pathway of rRNA processing in the nucleolus and cytosol / catalytic step 2 spliceosome / mRNA Splicing - Major Pathway / mRNA splicing, via spliceosome / rRNA processing ...: / snRNA catabolic process / TRAMP complex / RNA catabolic process / maturation of 5.8S rRNA / Major pathway of rRNA processing in the nucleolus and cytosol / catalytic step 2 spliceosome / mRNA Splicing - Major Pathway / mRNA splicing, via spliceosome / rRNA processing / RNA helicase activity / nuclear body / RNA helicase / nuclear speck / DNA damage response / nucleolus / ATP hydrolysis activity / RNA binding / zinc ion binding / nucleoplasm / ATP binding / nucleus 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.5 Å | |||||||||||||||
 データ登録者 データ登録者 | Gerlach P / Lingaraju M / Salerno-Kochan A / Bonneau F / Basquin J / Conti E | |||||||||||||||
| 資金援助 |  ドイツ, European Union, 4件 ドイツ, European Union, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2022 ジャーナル: Mol Cell / 年: 2022タイトル: Structure and regulation of the nuclear exosome targeting complex guides RNA substrates to the exosome. 著者: Piotr Gerlach / William Garland / Mahesh Lingaraju / Anna Salerno-Kochan / Fabien Bonneau / Jérôme Basquin / Torben Heick Jensen / Elena Conti /   要旨: In mammalian cells, spurious transcription results in a vast repertoire of unproductive non-coding RNAs, whose deleterious accumulation is prevented by rapid decay. The nuclear exosome targeting ...In mammalian cells, spurious transcription results in a vast repertoire of unproductive non-coding RNAs, whose deleterious accumulation is prevented by rapid decay. The nuclear exosome targeting (NEXT) complex plays a central role in directing non-functional transcripts to exosome-mediated degradation, but the structural and molecular mechanisms remain enigmatic. Here, we elucidated the architecture of the human NEXT complex, showing that it exists as a dimer of MTR4-ZCCHC8-RBM7 heterotrimers. Dimerization preconfigures the major MTR4-binding region of ZCCHC8 and arranges the two MTR4 helicases opposite to each other, with each protomer able to function on many types of RNAs. In the inactive state of the complex, the 3' end of an RNA substrate is enclosed in the MTR4 helicase channel by a ZCCHC8 C-terminal gatekeeping domain. The architecture of a NEXT-exosome assembly points to the molecular and regulatory mechanisms with which the NEXT complex guides RNA substrates to the exosome. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14510.map.gz emd_14510.map.gz | 14.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14510-v30.xml emd-14510-v30.xml emd-14510.xml emd-14510.xml | 17 KB 17 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_14510_fsc.xml emd_14510_fsc.xml | 17.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_14510.png emd_14510.png | 83.2 KB | ||
| マスクデータ |  emd_14510_msk_1.map emd_14510_msk_1.map | 216 MB |  マスクマップ マスクマップ | |
| その他 |  emd_14510_half_map_1.map.gz emd_14510_half_map_1.map.gz emd_14510_half_map_2.map.gz emd_14510_half_map_2.map.gz | 171.8 MB 171.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14510 http://ftp.pdbj.org/pub/emdb/structures/EMD-14510 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14510 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14510 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_14510_validation.pdf.gz emd_14510_validation.pdf.gz | 687.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_14510_full_validation.pdf.gz emd_14510_full_validation.pdf.gz | 687.5 KB | 表示 | |
| XML形式データ |  emd_14510_validation.xml.gz emd_14510_validation.xml.gz | 20.6 KB | 表示 | |
| CIF形式データ |  emd_14510_validation.cif.gz emd_14510_validation.cif.gz | 27.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14510 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14510 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14510 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14510 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7z4yMC  7z4zC  7z52C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14510.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14510.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | NEXT_S_overall_reconstruction_postprocessed | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.094 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_14510_msk_1.map emd_14510_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
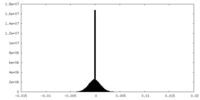
| 密度ヒストグラム |
-ハーフマップ: NEXT S overall reconstruction half map 2
| ファイル | emd_14510_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | NEXT_S_overall_reconstruction_half_map_2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
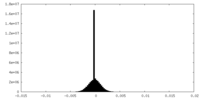
| 密度ヒストグラム |
-ハーフマップ: NEXT S overall reconstruction half map 1
| ファイル | emd_14510_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | NEXT_S_overall_reconstruction_half_map_1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
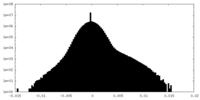
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human NEXT dimer - overall reconstruction of the core complex
| 全体 | 名称: Human NEXT dimer - overall reconstruction of the core complex |
|---|---|
| 要素 |
|
-超分子 #1: Human NEXT dimer - overall reconstruction of the core complex
| 超分子 | 名称: Human NEXT dimer - overall reconstruction of the core complex タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
-分子 #1: Zinc finger CCHC domain-containing protein 8
| 分子 | 名称: Zinc finger CCHC domain-containing protein 8 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 34.668961 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GPDSENGVGD AELRERLRQC EETIEQLRAE NQELKRKLNI LTRPSGILVN DTKLDGPILQ ILFMNNAISK QYHQEIEEFV SNLVKRFEE QQKNDVEKTS FNLLPQPSSI VLEEDHKVEE SCAIKNNKEA FSVVGSVLYF TNFCLDKLGQ PLLNENPQLS E GWEIPKYH ...文字列: GPDSENGVGD AELRERLRQC EETIEQLRAE NQELKRKLNI LTRPSGILVN DTKLDGPILQ ILFMNNAISK QYHQEIEEFV SNLVKRFEE QQKNDVEKTS FNLLPQPSSI VLEEDHKVEE SCAIKNNKEA FSVVGSVLYF TNFCLDKLGQ PLLNENPQLS E GWEIPKYH QVFSHIVSLE GQEIQVKAKR PKPHCFNCGS EEHQMKDCPM PRNAARISEK RKEYMDACGE ANNQNFQQRY HA EEVEERF GRFKPGVISE ELQDALGVTD KSLPPFIYRM RQLGYPPGWL KEAELENSGL ALYD |
-分子 #2: Exosome RNA helicase MTR4
| 分子 | 名称: Exosome RNA helicase MTR4 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO / EC番号: RNA helicase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 118.32207 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GPDSMADAFG DELFSVFEGD STTAAGTKKD KEKDKGKWKG PPGSADKAGK RFDGKLQSES TNNGKNKRDV DFEGTDEPIF GKKPRIEES ITEDLSLADL MPRVKVQSVE TVEGCTHEVA LPAEEDYLPL KPRVGKAAKE YPFILDAFQR EAIQCVDNNQ S VLVSAHTS ...文字列: GPDSMADAFG DELFSVFEGD STTAAGTKKD KEKDKGKWKG PPGSADKAGK RFDGKLQSES TNNGKNKRDV DFEGTDEPIF GKKPRIEES ITEDLSLADL MPRVKVQSVE TVEGCTHEVA LPAEEDYLPL KPRVGKAAKE YPFILDAFQR EAIQCVDNNQ S VLVSAHTS AGKTVCAEYA IALALREKQR VIFTSPIKAL SNQKYREMYE EFQDVGLMTG DVTINPTASC LVMTTEILRS ML YRGSEVM REVAWVIFDE IHYMRDSERG VVWEETIILL PDNVHYVFLS ATIPNARQFA EWICHLHKQP CHVIYTDYRP TPL QHYIFP AGGDGLHLVV DENGDFREDN FNTAMQVLRD AGDLAKGDQK GRKGGTKGPS NVFKIVKMIM ERNFQPVIIF SFSK KDCEA YALQMTKLDF NTDEEKKMVE EVFSNAIDCL SDEDKKLPQV EHVLPLLKRG IGIHHGGLLP ILKETIEILF SEGLI KALF ATETFAMGIN MPARTVLFTN ARKFDGKDFR WISSGEYIQM SGRAGRRGMD DRGIVILMVD EKMSPTIGKQ LLKGSA DPL NSAFHLTYNM VLNLLRVEEI NPEYMLEKSF YQFQHYRAIP GVVEKVKNSE EQYNKIVIPN EESVVIYYKI RQQLAKL GK EIEEYIHKPK YCLPFLQPGR LVKVKNEGDD FGWGVVVNFS KKSNVKPNSG ELDPLYVVEV LLRCSKESLK NSATEAAK P AKPDEKGEMQ VVPVLVHLLS AISSVRLYIP KDLRPVDNRQ SVLKSIQEVQ KRFPDGIPLL DPIDDMGIQD QGLKKVIQK VEAFEHRMYS HPLHNDPNLE TVYTLCEKKA QIAIDIKSAK RELKKARTVL QMDELKCRKR VLRRLGFATS SDVIEMKGRV ACEISSADE LLLTEMMFNG LFNDLSAEQA TALLSCFVFQ ENSSEMPKLT EQLAGPLRQM QECAKRIAKV SAEAKLEIDE E TYLSSFKP HLMDVVYTWA TGATFAHICK MTDVFEGSII RCMRRLEELL RQMCQAAKAI GNTELENKFA EGITKIKRDI VF AASLYL |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE-PROPANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 2.09 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD 最大 デフォーカス(公称値): 2.3000000000000003 µm 最小 デフォーカス(公称値): 0.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z
Z Y
Y X
X