+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Tau SF subtomogram average relating to LOL2_SF Figure 4i-j | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Amyloid / Filament / Alzheimer's / helical / PROTEIN FIBRIL | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
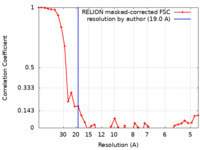
| 手法 | サブトモグラム平均法 / クライオ電子顕微鏡法 / 解像度: 19.0 Å | |||||||||
 データ登録者 データ登録者 | Jenkins J | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: CryoET of β-amyloid and tau within postmortem Alzheimer's disease brain. 著者: Madeleine A G Gilbert / Nayab Fatima / Joshua Jenkins / Thomas J O'Sullivan / Andreas Schertel / Yehuda Halfon / Martin Wilkinson / Tjado H J Morrema / Mirjam Geibel / Randy J Read / Neil A ...著者: Madeleine A G Gilbert / Nayab Fatima / Joshua Jenkins / Thomas J O'Sullivan / Andreas Schertel / Yehuda Halfon / Martin Wilkinson / Tjado H J Morrema / Mirjam Geibel / Randy J Read / Neil A Ranson / Sheena E Radford / Jeroen J M Hoozemans / René A W Frank /    要旨: A defining pathological feature of most neurodegenerative diseases is the assembly of proteins into amyloid that form disease-specific structures. In Alzheimer's disease, this is characterized by the ...A defining pathological feature of most neurodegenerative diseases is the assembly of proteins into amyloid that form disease-specific structures. In Alzheimer's disease, this is characterized by the deposition of β-amyloid and tau with disease-specific conformations. The in situ structure of amyloid in the human brain is unknown. Here, using cryo-fluorescence microscopy-targeted cryo-sectioning, cryo-focused ion beam-scanning electron microscopy lift-out and cryo-electron tomography, we determined in-tissue architectures of β-amyloid and tau pathology in a postmortem Alzheimer's disease donor brain. β-amyloid plaques contained a mixture of fibrils, some of which were branched, and protofilaments, arranged in parallel arrays and lattice-like structures. Extracellular vesicles and cuboidal particles defined the non-amyloid constituents of β-amyloid plaques. By contrast, tau inclusions formed parallel clusters of unbranched filaments. Subtomogram averaging a cluster of 136 tau filaments in a single tomogram revealed the polypeptide backbone conformation and filament polarity orientation of paired helical filaments within tissue. Filaments within most clusters were similar to each other, but were different between clusters, showing amyloid heterogeneity that is spatially organized by subcellular location. The in situ structural approaches outlined here for human donor tissues have applications to a broad range of neurodegenerative diseases. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_50162.map.gz emd_50162.map.gz | 3.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-50162-v30.xml emd-50162-v30.xml emd-50162.xml emd-50162.xml | 16.4 KB 16.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_50162_fsc.xml emd_50162_fsc.xml | 3.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_50162.png emd_50162.png | 19.3 KB | ||
| マスクデータ |  emd_50162_msk_1.map emd_50162_msk_1.map | 3.4 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-50162.cif.gz emd-50162.cif.gz | 5.1 KB | ||
| その他 |  emd_50162_half_map_1.map.gz emd_50162_half_map_1.map.gz emd_50162_half_map_2.map.gz emd_50162_half_map_2.map.gz | 2.4 MB 2.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-50162 http://ftp.pdbj.org/pub/emdb/structures/EMD-50162 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-50162 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-50162 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_50162_validation.pdf.gz emd_50162_validation.pdf.gz | 742.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_50162_full_validation.pdf.gz emd_50162_full_validation.pdf.gz | 741.6 KB | 表示 | |
| XML形式データ |  emd_50162_validation.xml.gz emd_50162_validation.xml.gz | 9.3 KB | 表示 | |
| CIF形式データ |  emd_50162_validation.cif.gz emd_50162_validation.cif.gz | 12.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50162 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50162 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50162 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50162 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_50162.map.gz / 形式: CCP4 / 大きさ: 3.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_50162.map.gz / 形式: CCP4 / 大きさ: 3.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.38 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_50162_msk_1.map emd_50162_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_50162_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_50162_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Microtubule-associated protein tau
| 全体 | 名称: Microtubule-associated protein tau |
|---|---|
| 要素 |
|
-超分子 #1: Microtubule-associated protein tau
| 超分子 | 名称: Microtubule-associated protein tau / タイプ: tissue / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: Brain Homo sapiens (ヒト) / 組織: Brain |
-分子 #1: Microtubule-associated protein tau
| 分子 | 名称: Microtubule-associated protein tau / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKST PTAEDVTAPL VDEGAPGKQA AAQPHTEIPE GTTAEEAGIG DTPSLEDEAA G HVTQEPES GKVVQEGFLR EPGPPGLSHQ LMSGMPGAPL LPEGPREATR ...文字列: MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKST PTAEDVTAPL VDEGAPGKQA AAQPHTEIPE GTTAEEAGIG DTPSLEDEAA G HVTQEPES GKVVQEGFLR EPGPPGLSHQ LMSGMPGAPL LPEGPREATR QPSGTGPEDT EG GRHAPEL LKHQLLGDLH QEGPPLKGAG GKERPGSKEE VDEDRDVDES SPQDSPPSKA SPA QDGRPP QTAAREATSI PGFPAEGAIP LPVDFLSKVS TEIPASEPDG PSVGRAKGQD APLE FTFHV EITPNVQKEQ AHSEEHLGRA AFPGAPGEGP EARGPSLGED TKEADLPEPS EKQPA AAPR GKPVSRVPQL KARMVSKSKD GTGSDDKKAK TSTRSSAKTL KNRPCLSPKH PTPGSS DPL IQPSSPAVCP EPPSSPKYVS SVTSRTGSSG AKEMKLKGAD GKTKIATPRG AAPPGQK GQ ANATRIPAKT PPAPKTPPSS GEPPKSGDRS GYSSPGSPGT PGSRSRTPSL PTPPTREP K KVAVVRTPPK SPSSAKSRLQ TAPVPMPDLK NVKSKIGSTE NLKHQPGGGK VQIINKKLD LSNVQSKCGS KDNIKHVPGG GSVQIVYKPV DLSKVTSKCG SLGNIHHKPG GGQVEVKSEK LDFKDRVQS KIGSLDNITH VPGGGNKKIE THKLTFRENA KAKTDHGAEI VYKSPVVSGD T SPRHLSNV SSTGSIDMVD SPQLATLADE VSASLAKQGL |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | サブトモグラム平均法 |
| 試料の集合状態 | tissue |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 平均電子線量: 2.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 6.5 µm / 最小 デフォーカス(公称値): 5.0 µm / 倍率(公称値): 53000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)