+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | RNA-induced tau amyloid fibril | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | amyloid fibril / complex / PROTEIN FIBRIL-RNA complex | |||||||||
| 機能・相同性 | Activation of AMPK downstream of NMDARs / PKR-mediated signaling / Isoform Tau-F of Microtubule-associated protein tau 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
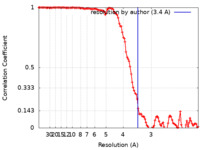
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Abskharon R / Sawaya MR | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2022 ジャーナル: Proc Natl Acad Sci U S A / 年: 2022タイトル: Cryo-EM structure of RNA-induced tau fibrils reveals a small C-terminal core that may nucleate fibril formation. 著者: Romany Abskharon / Michael R Sawaya / David R Boyer / Qin Cao / Binh A Nguyen / Duilio Cascio / David S Eisenberg /  要旨: In neurodegenerative diseases including Alzheimer’s and amyotrophic lateral sclerosis, proteins that bind RNA are found in aggregated forms in autopsied brains. Evidence suggests that RNA aids ...In neurodegenerative diseases including Alzheimer’s and amyotrophic lateral sclerosis, proteins that bind RNA are found in aggregated forms in autopsied brains. Evidence suggests that RNA aids nucleation of these pathological aggregates; however, the mechanism has not been investigated at the level of atomic structure. Here, we present the 3.4-Å resolution structure of fibrils of full-length recombinant tau protein in the presence of RNA, determined by electron cryomicroscopy (cryo-EM). The structure reveals the familiar in-register cross-β amyloid scaffold but with a small fibril core spanning residues Glu391 to Ala426, a region disordered in the fuzzy coat in all previously studied tau polymorphs. RNA is bound on the fibril surface to the positively charged residues Arg406 and His407 and runs parallel to the fibril axis. The fibrils dissolve when RNase is added, showing that RNA is necessary for fibril integrity. While this structure cannot exist simultaneously with the tau fibril structures extracted from patients’ brains, it could conceivably account for the nucleating effects of RNA cofactors followed by remodeling as fibrils mature. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25364.map.gz emd_25364.map.gz | 7.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25364-v30.xml emd-25364-v30.xml emd-25364.xml emd-25364.xml | 11.8 KB 11.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_25364_fsc.xml emd_25364_fsc.xml | 11.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_25364.png emd_25364.png | 137.1 KB | ||
| Filedesc metadata |  emd-25364.cif.gz emd-25364.cif.gz | 5.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25364 http://ftp.pdbj.org/pub/emdb/structures/EMD-25364 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25364 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25364 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_25364_validation.pdf.gz emd_25364_validation.pdf.gz | 564.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_25364_full_validation.pdf.gz emd_25364_full_validation.pdf.gz | 564.4 KB | 表示 | |
| XML形式データ |  emd_25364_validation.xml.gz emd_25364_validation.xml.gz | 10.4 KB | 表示 | |
| CIF形式データ |  emd_25364_validation.cif.gz emd_25364_validation.cif.gz | 13.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25364 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25364 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25364 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25364 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7sp1MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 電子顕微鏡画像生データ |  EMPIAR-11004 (タイトル: Cryo-EM structure of RNA-induced tau fibrils reveals a small C-terminal core that may nucleate fibril formation EMPIAR-11004 (タイトル: Cryo-EM structure of RNA-induced tau fibrils reveals a small C-terminal core that may nucleate fibril formationData size: 2.4 TB Data #1: Unaligned movies of recombinant tau amyloid fibrils formed in the presence of RNA [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25364.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25364.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Complex of tau protein and mouse RNA
| 全体 | 名称: Complex of tau protein and mouse RNA |
|---|---|
| 要素 |
|
-超分子 #1: Complex of tau protein and mouse RNA
| 超分子 | 名称: Complex of tau protein and mouse RNA / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Isoform Tau-F of Microtubule-associated protein tau
| 分子 | 名称: Isoform Tau-F of Microtubule-associated protein tau / タイプ: protein_or_peptide / ID: 1 / コピー数: 15 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 45.919871 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKSTP TAEDVTAPLV DEGAPGKQA AAQPHTEIPE GTTAEEAGIG DTPSLEDEAA GHVTQARMVS KSKDGTGSDD KKAKGADGKT KIATPRGAAP P GQKGQANA ...文字列: MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKSTP TAEDVTAPLV DEGAPGKQA AAQPHTEIPE GTTAEEAGIG DTPSLEDEAA GHVTQARMVS KSKDGTGSDD KKAKGADGKT KIATPRGAAP P GQKGQANA TRIPAKTPPA PKTPPSSGEP PKSGDRSGYS SPGSPGTPGS RSRTPSLPTP PTREPKKVAV VRTPPKSPSS AK SRLQTAP VPMPDLKNVK SKIGSTENLK HQPGGGKVQI INKKLDLSNV QSKCGSKDNI KHVPGGGSVQ IVYKPVDLSK VTS KCGSLG NIHHKPGGGQ VEVKSEKLDF KDRVQSKIGS LDNITHVPGG GNKKIETHKL TFRENAKAKT DHGAEIVYKS PVVS GDTSP RHLSNVSSTG SIDMVDSPQL ATLADEVSAS LAKQGL UniProtKB: Isoform Tau-F of Microtubule-associated protein tau |
-分子 #2: RNA (5'-R(*AP*AP*AP*AP*AP*AP*AP*AP*AP*A)-3')
| 分子 | 名称: RNA (5'-R(*AP*AP*AP*AP*AP*AP*AP*AP*AP*A)-3') / タイプ: rna / ID: 2 / コピー数: 2 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 3.2471 KDa |
| 配列 | 文字列: AAAAAAAAAA |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7 / 構成要素 - 濃度: 20.0 mM / 構成要素 - 名称: ammonium acetate |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 240 sec. |
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 4728 / 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.9 µm / 最小 デフォーカス(公称値): 0.76 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 温度因子: 84.4 / 当てはまり具合の基準: Correlation coefficient |
|---|---|
| 得られたモデル |  PDB-7sp1: |
 ムービー
ムービー コントローラー
コントローラー







 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)