+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | 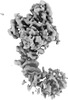 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the unliganded form of NLR family apoptosis inhibitory protein 5 (NAIP5) with partial LRR domain | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | |||||||||
 データ登録者 データ登録者 | Paidimuddala B / Cao J / Xie Q / Wu H / Zhang L | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2023 ジャーナル: Nat Struct Mol Biol / 年: 2023タイトル: Mechanism of NAIP-NLRC4 inflammasome activation revealed by cryo-EM structure of unliganded NAIP5. 著者: Bhaskar Paidimuddala / Jianhao Cao / Grady Nash / Qing Xie / Hao Wu / Liman Zhang /  要旨: The nucleotide-binding domain (NBD), leucine rich repeat (LRR) domain containing protein family (NLR family) apoptosis inhibitory proteins (NAIPs) are cytosolic receptors that play critical roles in ...The nucleotide-binding domain (NBD), leucine rich repeat (LRR) domain containing protein family (NLR family) apoptosis inhibitory proteins (NAIPs) are cytosolic receptors that play critical roles in the host defense against bacterial infection. NAIPs interact with conserved bacterial ligands and activate the NLR family caspase recruitment domain containing protein 4 (NLRC4) to initiate the NAIP-NLRC4 inflammasome pathway. Here we found the process of NAIP activation is completely different from NLRC4. Our cryo-EM structure of unliganded mouse NAIP5 adopts an unprecedented wide-open conformation, with the nucleating surface fully exposed and accessible to recruit inactive NLRC4. Upon ligand binding, the winged helix domain (WHD) of NAIP5 undergoes roughly 20° rotation to form a steric clash with the inactive NLRC4, which triggers the conformational change of NLRC4 from inactive to active state. We also show the rotation of WHD places the 17-18 loop at a position that directly bind the active NLRC4 and stabilize the NAIP5-NLRC4 complex. Overall, these data provide structural mechanisms of inactive NAIP5, the process of NAIP5 activation and NAIP-dependent NLRC4 activation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_24389.map.gz emd_24389.map.gz | 57 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-24389-v30.xml emd-24389-v30.xml emd-24389.xml emd-24389.xml | 14.5 KB 14.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_24389.png emd_24389.png | 64.1 KB | ||
| その他 |  emd_24389_half_map_1.map.gz emd_24389_half_map_1.map.gz emd_24389_half_map_2.map.gz emd_24389_half_map_2.map.gz | 59.3 MB 59.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-24389 http://ftp.pdbj.org/pub/emdb/structures/EMD-24389 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24389 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24389 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_24389_validation.pdf.gz emd_24389_validation.pdf.gz | 656 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_24389_full_validation.pdf.gz emd_24389_full_validation.pdf.gz | 655.5 KB | 表示 | |
| XML形式データ |  emd_24389_validation.xml.gz emd_24389_validation.xml.gz | 12.2 KB | 表示 | |
| CIF形式データ |  emd_24389_validation.cif.gz emd_24389_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24389 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24389 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24389 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24389 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_24389.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_24389.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.0694 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_24389_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
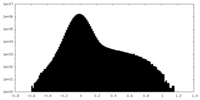
| 投影像・断面図 |
| ||||||||||||
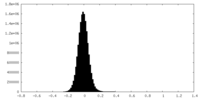
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_24389_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
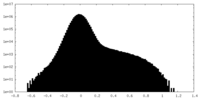
| 投影像・断面図 |
| ||||||||||||
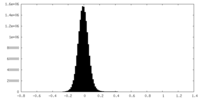
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Pre-liganded form of NAIP5
| 全体 | 名称: Pre-liganded form of NAIP5 |
|---|---|
| 要素 |
|
-超分子 #1: Pre-liganded form of NAIP5
| 超分子 | 名称: Pre-liganded form of NAIP5 / タイプ: cell / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: NLR family) apoptosis inhibitory protein 5 (NAIP5)
| 分子 | 名称: NLR family) apoptosis inhibitory protein 5 (NAIP5) / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MDYKDDDDKL AEHGESSEDR ISEIDYEFLP ELSALLGVDA FQVAKSQEEE EHKERMKMKK GFNSQMRSEA KRLKTFETYD TFRSWTPQEM AAAGFYHTGV RLGVQCFCCS LILFGNSLRK LPIERHKKLR PECEFLQGKD VGNIGKYDIR VKRPEKMLRG GKARYHEEEA ...文字列: MDYKDDDDKL AEHGESSEDR ISEIDYEFLP ELSALLGVDA FQVAKSQEEE EHKERMKMKK GFNSQMRSEA KRLKTFETYD TFRSWTPQEM AAAGFYHTGV RLGVQCFCCS LILFGNSLRK LPIERHKKLR PECEFLQGKD VGNIGKYDIR VKRPEKMLRG GKARYHEEEA RLESFEDWPF YAHGTSPRV LSAAGFVFTG KRDTVQCFSC GGSLGNWEEG DDPWKEHAKW FPKCEFLQSK KSSEEIAQYI QSYEGFVHV TGEHFVKSWV RRELPMVSAY CNDSVFANEE LRMDMFKDWP QESPVGVEAL V RAGFFYTG KKDIVRCFSC GGCLEKWAEG DDPMEDHIKF FPECVFLQTL KSSAEVIPTL QS QYALPEA TETTRESNHG DAAAVHSTVV DLGRSEAQWF QEARSLSEQL RDNYTKATFR HMN LPEVCS SLGTDHLLSC DVSIISKHIS QPVQEALTIP EVFSNLNSVM CVEGETGSGK TTFL KRIAF LWASGCCPLL YRFQLVFYLS LSSITPDQGL ANIICAQLLG AGGCISEVCL SSSIQ QLQH QVLFLLDDYS GLASLPQALH TLITKNYLSR TCLLIAVHTN RVRDIRLYLG TSLEIQ EFP FYNTVSVLRK FFSHDIICVE KLIIYFIDNK DLQGVYKTPL FVAAVCTDWI QNASAQD KF QDVTLFQSYM QYLSLKYKAT AEPLQATVSS CGQLALTGLF SSCFEFNSDD LAEAGVDE D EKLTTLLMSK FTAQRLRPVY RFLGPLFQEF LAAVRLTELL SSDRQEDQDL GLYYLRQID SPLKAINSFN IFLYYVSSHS SSKAAPTVVS HLLQLVDEKE SLENMSENED YMKLHPQTFL WFQFVRGLW LVSPESSSSF VSEHLLRLAL IFAYESNTVA ECSPFILQFL RGKTLALRVL N LQYFRDHP ESLLLLRSLK VSINGNKMSS YVDYSFKTYF ENLQPPAIDE EYTSAFEHIS EW RRNFAQD EEIIKNYENI RPRALPDISE GYWKLSPKPC KIPKLEVQVN NTDAADQALL QVL MEVFSA SQSIEFRLFN SSGFLESICP ALELSKASVT KCSMSRLELS RAEQELLLTL PALQ SLEVS ETNQLPEQLF HNLHKFLGLK ELCVRLDGKP NVLSVLPREF PNLLHMEKLS IQTST ESDL SKLVKFIQNF PNLHVFHLKC DFLSNCESLM AVLASCKKLR EIEFSGRCFE AMTFVN ILP NFVSLKILNL KDQQFPDKET SEKFAQALGS LRNLEELLVP TGDGIHQVAK LIVRQCL QL PCLRVLTFHD ILDDDSVIEI ARAATSGGFQ KLENLDISMN HKITEEGYRN FFQALDNL P NLQELNICRN IPGRIQVQAT TVKALGQCVS RLPSLIRLHM LSWLLDEEDM KVINDVKER HPQSKRLIIF WKLIVPFSPV ILE |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | cell |
- 試料調製
試料調製
| 濃度 | 0.30 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 3.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC / 使用した粒子像数: 159513 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
-原子モデル構築 1
| 精密化 | プロトコル: OTHER |
|---|
 ムービー
ムービー コントローラー
コントローラー






 Z
Z Y
Y X
X