+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7uam | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Structure of human neuronal nitric oxide synthase R354A/G357D mutant heme domain in complex with (6-(3-(4,4-difluoropiperidin-1-yl)propyl)-4-methylpyridin-2-amine) | ||||||
 要素 要素 | Nitric oxide synthase, brain | ||||||
 キーワード キーワード | OXIDOREDUCTASE / nitric oxide synthase inhibitor / heme enzyme | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of membrane repolarization during ventricular cardiac muscle cell action potential / negative regulation of calcium ion transport into cytosol / Nitric oxide stimulates guanylate cyclase / myoblast fusion / ROS and RNS production in phagocytes / tetrahydrobiopterin binding / arginine binding / regulation of cardiac muscle contraction by calcium ion signaling / regulation of calcium ion transmembrane transport via high voltage-gated calcium channel / synaptic signaling by nitric oxide ...positive regulation of membrane repolarization during ventricular cardiac muscle cell action potential / negative regulation of calcium ion transport into cytosol / Nitric oxide stimulates guanylate cyclase / myoblast fusion / ROS and RNS production in phagocytes / tetrahydrobiopterin binding / arginine binding / regulation of cardiac muscle contraction by calcium ion signaling / regulation of calcium ion transmembrane transport via high voltage-gated calcium channel / synaptic signaling by nitric oxide / positive regulation of adenylate cyclase-activating G protein-coupled receptor signaling pathway / positive regulation of sodium ion transmembrane transport / peptidyl-cysteine S-nitrosylase activity / positive regulation of the force of heart contraction / cadmium ion binding / negative regulation of calcium ion transport / negative regulation of potassium ion transport / regulation of postsynaptic membrane potential / nitric oxide mediated signal transduction / sodium channel regulator activity / nitric-oxide synthase (NADPH) / regulation of neurogenesis / negative regulation of serotonin uptake / regulation of cardiac muscle contraction / nitric-oxide synthase activity / xenobiotic catabolic process / multicellular organismal response to stress / L-arginine catabolic process / striated muscle contraction / negative regulation of blood pressure / regulation of sodium ion transport / response to hormone / Ion homeostasis / nitric oxide biosynthetic process / photoreceptor inner segment / T-tubule / sarcoplasmic reticulum membrane / cell redox homeostasis / calyx of Held / sarcoplasmic reticulum / cell periphery / calcium channel regulator activity / establishment of localization in cell / sarcolemma / caveola / potassium ion transport / cellular response to growth factor stimulus / vasodilation / Z disc / calcium-dependent protein binding / calcium ion transport / FMN binding / NADP binding / flavin adenine dinucleotide binding / positive regulation of neuron apoptotic process / response to heat / scaffold protein binding / response to lipopolysaccharide / dendritic spine / transmembrane transporter binding / response to hypoxia / cytoskeleton / calmodulin binding / postsynaptic density / membrane raft / heme binding / synapse / positive regulation of DNA-templated transcription / perinuclear region of cytoplasm / positive regulation of transcription by RNA polymerase II / protein-containing complex / mitochondrion / nucleoplasm / nucleus / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 1.837 Å フーリエ合成 / 解像度: 1.837 Å | ||||||
 データ登録者 データ登録者 | Li, H. / Poulos, T.L. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Bioorg.Med.Chem. / 年: 2022 ジャーナル: Bioorg.Med.Chem. / 年: 2022タイトル: 2-Aminopyridines with a shortened amino sidechain as potent, selective, and highly permeable human neuronal nitric oxide synthase inhibitors. 著者: Vasu, D. / Li, H. / Hardy, C.D. / Poulos, T.L. / Silverman, R.B. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7uam.cif.gz 7uam.cif.gz | 720.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7uam.ent.gz pdb7uam.ent.gz | 591.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7uam.json.gz 7uam.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ua/7uam https://data.pdbj.org/pub/pdb/validation_reports/ua/7uam ftp://data.pdbj.org/pub/pdb/validation_reports/ua/7uam ftp://data.pdbj.org/pub/pdb/validation_reports/ua/7uam | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  7ts1C  7ts2C  7ts3C  7ts4C  7ts5C  7ts6C  7ts7C  7ts8C  7ts9C  7tsaC  7tsbC  7tscC  7tsdC  7tseC  7tsfC  7tsgC  7tshC  7tsiC  7tskC  7tslC  7tsmC  7tsnC  7tsoC  7tspC  7uanC  7uaoC  7us7C  7us8C  4uh5S S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 4分子 ABCD
| #1: タンパク質 | 分子量: 48996.781 Da / 分子数: 4 / 変異: R354A, G357D / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NOS1 / 器官: brain / プラスミド: pOWori / 発現宿主: Homo sapiens (ヒト) / 遺伝子: NOS1 / 器官: brain / プラスミド: pOWori / 発現宿主:  |
|---|
-非ポリマー , 6種, 1561分子 

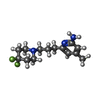








| #2: 化合物 | ChemComp-HEM / #3: 化合物 | ChemComp-H4B / #4: 化合物 | ChemComp-M5L / #5: 化合物 | ChemComp-GOL / #6: 化合物 | #7: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.74 Å3/Da / 溶媒含有率: 55.2 % / 解説: plates |
|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 7.2 詳細: 8% PEG3350 35mM citric acid 65mM Bis-Tris-Propane 10% glycerol 5mM TCEP |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  SSRL SSRL  / ビームライン: BL12-2 / 波長: 0.979 Å / ビームライン: BL12-2 / 波長: 0.979 Å | |||||||||||||||||||||||||||
| 検出器 | タイプ: DECTRIS PILATUS 6M / 検出器: PIXEL / 日付: 2022年2月21日 / 詳細: mirrors | |||||||||||||||||||||||||||
| 放射 | モノクロメーター: DOUBLE CRYSTAL SI(III) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||
| 放射波長 | 波長: 0.979 Å / 相対比: 1 | |||||||||||||||||||||||||||
| 反射 | 解像度: 1.837→39.22 Å / Num. obs: 173226 / % possible obs: 99.5 % / 冗長度: 9.1 % / Biso Wilson estimate: 27.54 Å2 / CC1/2: 0.996 / Rmerge(I) obs: 0.167 / Rpim(I) all: 0.059 / Rrim(I) all: 0.177 / Net I/σ(I): 8.9 | |||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  フーリエ合成 フーリエ合成開始モデル: 4UH5 解像度: 1.837→39.1291 Å / SU ML: 0.22 / 交差検証法: FREE R-VALUE / σ(F): 0.16 / 位相誤差: 23.1 / 立体化学のターゲット値: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 128.74 Å2 / Biso mean: 36.6418 Å2 / Biso min: 15.75 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.837→39.1291 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 30
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj










