+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7fsu | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | SDCBP PanDDA analysis group deposition -- The PDZ domans of SDCBP in complex with Z729726784 | ||||||
 要素 要素 | Syntenin-1 | ||||||
 キーワード キーワード | SIGNALING PROTEIN / Diamond I04-1 fragment screening / PanDDA / XChemExplorer | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報interleukin-5 receptor complex / interleukin-5 receptor binding / positive regulation of extracellular exosome assembly / syndecan binding / Neurofascin interactions / cytoskeletal anchor activity / substrate-dependent cell migration, cell extension / positive regulation of exosomal secretion / negative regulation of receptor internalization / frizzled binding ...interleukin-5 receptor complex / interleukin-5 receptor binding / positive regulation of extracellular exosome assembly / syndecan binding / Neurofascin interactions / cytoskeletal anchor activity / substrate-dependent cell migration, cell extension / positive regulation of exosomal secretion / negative regulation of receptor internalization / frizzled binding / Ephrin signaling / protein targeting to membrane / RIPK1-mediated regulated necrosis / positive regulation of transforming growth factor beta receptor signaling pathway / positive regulation of phosphorylation / positive regulation of epithelial to mesenchymal transition / phosphatidylinositol-4,5-bisphosphate binding / protein sequestering activity / regulation of mitotic cell cycle / adherens junction / positive regulation of JNK cascade / Regulation of necroptotic cell death / azurophil granule lumen / melanosome / extracellular vesicle / positive regulation of cell growth / actin cytoskeleton organization / nuclear membrane / blood microparticle / chemical synaptic transmission / Ras protein signal transduction / cytoskeleton / intracellular signal transduction / positive regulation of cell migration / membrane raft / protein heterodimerization activity / focal adhesion / positive regulation of cell population proliferation / synapse / Neutrophil degranulation / endoplasmic reticulum membrane / negative regulation of transcription by RNA polymerase II / extracellular space / extracellular exosome / extracellular region / nucleoplasm / identical protein binding / nucleus / membrane / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / フーリエ合成 /  分子置換 / 解像度: 1.97 Å 分子置換 / 解像度: 1.97 Å | ||||||
 データ登録者 データ登録者 | Bradshaw, W.J. / Katis, V.L. / Bountra, C. / von Delft, F. / Brennan, P.E. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: SDCBP PanDDA analysis group deposition 著者: Bradshaw, W.J. / Katis, V.L. / Bountra, C. / von Delft, F. / Brennan, P.E. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7fsu.cif.gz 7fsu.cif.gz | 311.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7fsu.ent.gz pdb7fsu.ent.gz | 255.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7fsu.json.gz 7fsu.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/fs/7fsu https://data.pdbj.org/pub/pdb/validation_reports/fs/7fsu ftp://data.pdbj.org/pub/pdb/validation_reports/fs/7fsu ftp://data.pdbj.org/pub/pdb/validation_reports/fs/7fsu | HTTPS FTP |
|---|
-グループ登録
| ID | G_1002262 (34エントリ) |
|---|---|
| タイトル | SDCBP PanDDA analysis group deposition |
| タイプ | changed state |
| 解説 | XDomainX of XOrganismX SDCBP screened against the XXX Fragment Library by X-ray Crystallography at the XChem facility of Diamond Light Source beamline I04-1 |
-関連構造データ
| 関連構造データ |  8bluS S: 精密化の開始モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 4分子 ABCD
| #1: タンパク質 | 分子量: 21430.881 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: SDCBP, MDA9, SYCL / 発現宿主: Homo sapiens (ヒト) / 遺伝子: SDCBP, MDA9, SYCL / 発現宿主:  |
|---|
-非ポリマー , 7種, 362分子 


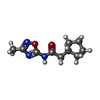

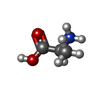







| #2: 化合物 | ChemComp-EDO / #3: 化合物 | #4: 化合物 | #5: 化合物 | ChemComp-YDU / | #6: 化合物 | #7: 化合物 | ChemComp-ALA / | #8: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.67 Å3/Da / 溶媒含有率: 53.91 % / Mosaicity: 0 ° |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 6.5 詳細: 100 mM Morpheus amino acids, 100 mM Morpheus buffer system 1, 43% Morpheus precipitant mix 3 |
-データ収集
| 回折 | 平均測定温度: 100 K | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  Diamond Diamond  / ビームライン: I04-1 / 波長: 0.9179 Å / ビームライン: I04-1 / 波長: 0.9179 Å | ||||||||||||||||||||||||||||||
| 検出器 | タイプ: DECTRIS PILATUS 6M / 検出器: PIXEL / 日付: 2022年4月14日 | ||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||
| 放射波長 | 波長: 0.9179 Å / 相対比: 1 | ||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.97→114.3 Å / Num. obs: 64274 / % possible obs: 99.9 % / 冗長度: 3.5 % / CC1/2: 0.976 / Rmerge(I) obs: 0.122 / Rpim(I) all: 0.077 / Rrim(I) all: 0.145 / Net I/σ(I): 10.4 / Num. measured all: 223464 / Scaling rejects: 0 | ||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
-位相決定
| 位相決定 | 手法:  分子置換 分子置換 |
|---|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  フーリエ合成 フーリエ合成開始モデル: 8BLU 解像度: 1.97→114.3 Å / Cor.coef. Fo:Fc: 0.962 / Cor.coef. Fo:Fc free: 0.942 / SU B: 14.759 / SU ML: 0.192 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.2 / ESU R Free: 0.175 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : WITH TLS ADDED
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 216.94 Å2 / Biso mean: 44.376 Å2 / Biso min: 22.85 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.97→114.3 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.971→2.023 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj












