+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6701 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 3D cryo-EM reconstruction of Microtubule-WHAMM complex | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | microtubule / helical reconstruction / STRUCTURAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報small GTPase binding => GO:0031267 / regulation of cell cycle => GO:0051726 / plasma membrane tubulation / Arp2/3 complex-mediated actin nucleation / Arp2/3 complex binding / positive regulation of actin nucleation / : / focal adhesion assembly / lamellipodium assembly / endoplasmic reticulum to Golgi vesicle-mediated transport ...small GTPase binding => GO:0031267 / regulation of cell cycle => GO:0051726 / plasma membrane tubulation / Arp2/3 complex-mediated actin nucleation / Arp2/3 complex binding / positive regulation of actin nucleation / : / focal adhesion assembly / lamellipodium assembly / endoplasmic reticulum to Golgi vesicle-mediated transport / endoplasmic reticulum-Golgi intermediate compartment membrane / actin filament organization / cytoplasmic vesicle membrane / actin binding / microtubule binding / microtubule / Golgi membrane / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 4.5 Å | |||||||||
 データ登録者 データ登録者 | Liu T / Wang HW | |||||||||
 引用 引用 |  ジャーナル: J Mol Biol / 年: 2017 ジャーナル: J Mol Biol / 年: 2017タイトル: Structural Insights of WHAMM's Interaction with Microtubules by Cryo-EM. 著者: Tianyang Liu / Anbang Dai / Yong Cao / Rui Zhang / Meng-Qiu Dong / Hong-Wei Wang /   要旨: WASP homolog associated with actin, membranes, and microtubules (WHAMM) is a vertebrate protein functioning in membrane tubulation for intracellular membrane trafficking and specific organelle ...WASP homolog associated with actin, membranes, and microtubules (WHAMM) is a vertebrate protein functioning in membrane tubulation for intracellular membrane trafficking and specific organelle formation. Composed of multiple domains, WHAMM can bind to membrane and microtubule (MT) and promote actin polymerization nucleation. Previous work revealed that WHAMM's activity to promote actin nucleation is repressed upon binding to MTs. Here, we discovered that WHAMM interacts with αβ-tubulin through a small peptide motif within its MT-binding domain. We reconstructed a high-resolution structure of WHAMM's MT-binding motif (MBM) assembling around MTs using cryo-electron microscopy and verified it with chemical cross-linking and mass spectrometry analysis. We also detected a conformational switch of this motif between the non-MT-bound state and the MT-bound state. These discoveries provide new insights into the mechanism by which WHAMM coordinates actin and MT networks, the two major cytoskeletal systems involved in membrane trafficking and membrane remodeling. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6701.map.gz emd_6701.map.gz | 141.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6701-v30.xml emd-6701-v30.xml emd-6701.xml emd-6701.xml | 8.6 KB 8.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_6701.png emd_6701.png | 298.9 KB | ||
| Filedesc metadata |  emd-6701.cif.gz emd-6701.cif.gz | 4.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6701 http://ftp.pdbj.org/pub/emdb/structures/EMD-6701 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6701 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6701 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6701_validation.pdf.gz emd_6701_validation.pdf.gz | 501.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6701_full_validation.pdf.gz emd_6701_full_validation.pdf.gz | 501.3 KB | 表示 | |
| XML形式データ |  emd_6701_validation.xml.gz emd_6701_validation.xml.gz | 8.3 KB | 表示 | |
| CIF形式データ |  emd_6701_validation.cif.gz emd_6701_validation.cif.gz | 9.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6701 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6701 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6701 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6701 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6701.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6701.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.306 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
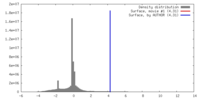
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Ternary complex of alpha,beta-tubulin dimer with microtubule bind...
| 全体 | 名称: Ternary complex of alpha,beta-tubulin dimer with microtubule binding motif of WHAMM |
|---|---|
| 要素 |
|
-超分子 #1: Ternary complex of alpha,beta-tubulin dimer with microtubule bind...
| 超分子 | 名称: Ternary complex of alpha,beta-tubulin dimer with microtubule binding motif of WHAMM タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: WASP homolog-associated protein with actin, membranes and microtubules
| 分子 | 名称: WASP homolog-associated protein with actin, membranes and microtubules タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 4.414182 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: IQMKRDKIKE EEQKKKEWIN QERQKTLQRL RSFK UniProtKB: WASP homolog-associated protein with actin, membranes and microtubules |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 6.8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 8.6 Å 想定した対称性 - らせんパラメータ - ΔΦ: -25.762 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 4.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 8000 |
|---|---|
| 初期モデル | モデルのタイプ: OTHER |
| 最終 角度割当 | タイプ: NOT APPLICABLE |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)