+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of heteromeric amyloid filament of TDP-43 and AXNA11 from FTLD-TDP Type C (variant 2) | |||||||||
 マップデータ マップデータ | TDP-43/ANXA11 FTLD-TDP type C heteroamyloid filament variant 2 map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | TDP-43 / ANXA11 / amyloid / heteromeric amyloid / FTLD-TDP / neurodegeneration / dementia / brain / protein filament / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytokinetic process / nuclear inner membrane organization / interchromatin granule / perichromatin fibrils / 3'-UTR-mediated mRNA destabilization / specific granule / calcium-dependent phospholipid binding / phosphatidylethanolamine binding / S100 protein binding / vesicle membrane ...cytokinetic process / nuclear inner membrane organization / interchromatin granule / perichromatin fibrils / 3'-UTR-mediated mRNA destabilization / specific granule / calcium-dependent phospholipid binding / phosphatidylethanolamine binding / S100 protein binding / vesicle membrane / azurophil granule / 3'-UTR-mediated mRNA stabilization / intracellular membraneless organelle / phosphatidylserine binding / negative regulation by host of viral transcription / phagocytosis / phagocytic vesicle / pre-mRNA intronic binding / response to endoplasmic reticulum stress / RNA splicing / negative regulation of protein phosphorylation / mRNA 3'-UTR binding / molecular condensate scaffold activity / regulation of circadian rhythm / regulation of protein stability / positive regulation of insulin secretion / positive regulation of protein import into nucleus / spindle / response to calcium ion / cytoplasmic stress granule / mRNA processing / calcium-dependent protein binding / rhythmic process / melanosome / MHC class II protein complex binding / nuclear envelope / double-stranded DNA binding / midbody / regulation of gene expression / collagen-containing extracellular matrix / regulation of apoptotic process / amyloid fibril formation / regulation of cell cycle / nuclear speck / RNA polymerase II cis-regulatory region sequence-specific DNA binding / negative regulation of gene expression / lipid binding / calcium ion binding / chromatin / mitochondrion / DNA binding / RNA binding / extracellular exosome / nucleoplasm / identical protein binding / membrane / nucleus / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 2.9 Å | |||||||||
 データ登録者 データ登録者 | Arseni D / Ryskeldi-Falcon B | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: bioRxiv / 年: 2024 ジャーナル: bioRxiv / 年: 2024タイトル: Heteromeric amyloid filaments of ANXA11 and TDP-43 in FTLD-TDP Type C. 著者: Diana Arseni / Takashi Nonaka / Max H Jacobsen / Alexey G Murzin / Laura Cracco / Sew Y Peak-Chew / Holly J Garringer / Ito Kawakami / Hisaomi Suzuki / Misumoto Onaya / Yuko Saito / Shigeo ...著者: Diana Arseni / Takashi Nonaka / Max H Jacobsen / Alexey G Murzin / Laura Cracco / Sew Y Peak-Chew / Holly J Garringer / Ito Kawakami / Hisaomi Suzuki / Misumoto Onaya / Yuko Saito / Shigeo Murayama / Changiz Geula / Ruben Vidal / Kathy L Newell / Marsel Mesulam / Bernardino Ghetti / Masato Hasegawa / Benjamin Ryskeldi-Falcon 要旨: Neurodegenerative diseases are characterised by the abnormal filamentous assembly of specific proteins in the central nervous system . Human genetic studies established a causal role for protein ...Neurodegenerative diseases are characterised by the abnormal filamentous assembly of specific proteins in the central nervous system . Human genetic studies established a causal role for protein assembly in neurodegeneration . However, the underlying molecular mechanisms remain largely unknown, which is limiting progress in developing clinical tools for these diseases. Recent advances in electron cryo-microscopy (cryo-EM) have enabled the structures of the protein filaments to be determined from patient brains . All diseases studied to date have been characterised by the self-assembly of a single intracellular protein in homomeric amyloid filaments, including that of TAR DNA-binding protein 43 (TDP-43) in amyotrophic lateral sclerosis (ALS) and frontotemporal lobar degeneration with TDP-43 inclusions (FTLD-TDP) Types A and B . Here, we used cryo-EM to determine filament structures from the brains of individuals with FTLD-TDP Type C, one of the most common forms of sporadic FTLD-TDP. Unexpectedly, the structures revealed that a second protein, annexin A11 (ANXA11), co-assembles with TDP-43 in heteromeric amyloid filaments. The ordered filament fold is formed by TDP-43 residues G282/284-N345 and ANXA11 residues L39-L74 from their respective low-complexity domains (LCDs). Regions of TDP-43 and ANXA11 previously implicated in protein-protein interactions form an extensive hydrophobic interface at the centre of the filament fold. Immunoblots of the filaments revealed that the majority of ANXA11 exists as a ∼22 kDa N-terminal fragment (NTF) lacking the annexin core domain. Immunohistochemistry of brain sections confirmed the co-localisation of ANXA11 and TDP-43 in inclusions, redefining the histopathology of FTLD-TDP Type C. This work establishes a central role for ANXA11 in FTLD-TDP Type C. The unprecedented formation of heteromeric amyloid filaments in human brain revises our understanding of amyloid assembly and may be of significance for the pathogenesis of neurodegenerative diseases. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_50621.map.gz emd_50621.map.gz | 59.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-50621-v30.xml emd-50621-v30.xml emd-50621.xml emd-50621.xml | 18.9 KB 18.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_50621.png emd_50621.png | 52.7 KB | ||
| マスクデータ |  emd_50621_msk_1.map emd_50621_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-50621.cif.gz emd-50621.cif.gz | 5.4 KB | ||
| その他 |  emd_50621_half_map_1.map.gz emd_50621_half_map_1.map.gz emd_50621_half_map_2.map.gz emd_50621_half_map_2.map.gz | 49.6 MB 49.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-50621 http://ftp.pdbj.org/pub/emdb/structures/EMD-50621 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-50621 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-50621 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_50621_validation.pdf.gz emd_50621_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_50621_full_validation.pdf.gz emd_50621_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_50621_validation.xml.gz emd_50621_validation.xml.gz | 12 KB | 表示 | |
| CIF形式データ |  emd_50621_validation.cif.gz emd_50621_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50621 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50621 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50621 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50621 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9fofMC  9forC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_50621.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_50621.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | TDP-43/ANXA11 FTLD-TDP type C heteroamyloid filament variant 2 map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.86 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_50621_msk_1.map emd_50621_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
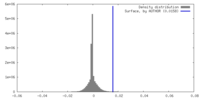
| 密度ヒストグラム |
-ハーフマップ: TDP-43/ANXA11 FTLD-TDP type C heteroamyloid filament variant 2 half 1
| ファイル | emd_50621_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | TDP-43/ANXA11 FTLD-TDP type C heteroamyloid filament variant 2 half 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
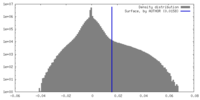
| 密度ヒストグラム |
-ハーフマップ: TDP-43/ANXA11 FTLD-TDP type C heteroamyloid filament variant 2 half 2
| ファイル | emd_50621_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | TDP-43/ANXA11 FTLD-TDP type C heteroamyloid filament variant 2 half 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : heteromeric amyloid filament of TDP-43 and AXNA11 from FTLD-TDP T...
| 全体 | 名称: heteromeric amyloid filament of TDP-43 and AXNA11 from FTLD-TDP Type C (variant 1) |
|---|---|
| 要素 |
|
-超分子 #1: heteromeric amyloid filament of TDP-43 and AXNA11 from FTLD-TDP T...
| 超分子 | 名称: heteromeric amyloid filament of TDP-43 and AXNA11 from FTLD-TDP Type C (variant 1) タイプ: tissue / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: Brain Homo sapiens (ヒト) / 組織: Brain |
-分子 #1: TAR DNA-binding protein 43
| 分子 | 名称: TAR DNA-binding protein 43 / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: Brain Homo sapiens (ヒト) / 組織: Brain |
| 分子量 | 理論値: 6.23187 KDa |
| 配列 | 文字列: GFGNQGGFGN SRGGGAGLGN NQGSNMGGGM NFGAFSINPA MMAAAQAALQ SSWGMMGMLA SQQN UniProtKB: TAR DNA-binding protein 43 |
-分子 #2: Annexin A11
| 分子 | 名称: Annexin A11 / タイプ: protein_or_peptide / ID: 2 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: Brain Homo sapiens (ヒト) / 組織: Brain |
| 分子量 | 理論値: 3.805148 KDa |
| 配列 | 文字列: LDNVATYAGQ FNQDYLSGMA ANMSGTFGGA NMPNLY UniProtKB: Annexin A11 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOCONTINUUM (6k x 4k) 平均電子線量: 38.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 4.96 Å 想定した対称性 - らせんパラメータ - ΔΦ: -1.92 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 2.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 10842 |
|---|---|
| 初期モデル | モデルのタイプ: NONE |
| 最終 角度割当 | タイプ: NOT APPLICABLE |
 ムービー
ムービー コントローラー
コントローラー





 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)