+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human claudin-4 complex with Clostridium perfringens enterotoxin | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | claudin / enterotoxin / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報paracellular transport / positive regulation of metallopeptidase activity / calcium-independent cell-cell adhesion via plasma membrane cell-adhesion molecules / Tight junction interactions / bicellular tight junction assembly / apicolateral plasma membrane / regulation of cell morphogenesis / tight junction / positive regulation of wound healing / chloride channel activity ...paracellular transport / positive regulation of metallopeptidase activity / calcium-independent cell-cell adhesion via plasma membrane cell-adhesion molecules / Tight junction interactions / bicellular tight junction assembly / apicolateral plasma membrane / regulation of cell morphogenesis / tight junction / positive regulation of wound healing / chloride channel activity / renal absorption / chloride channel complex / lateral plasma membrane / bicellular tight junction / establishment of skin barrier / basal plasma membrane / response to progesterone / female pregnancy / circadian rhythm / transmembrane signaling receptor activity / cell-cell junction / toxin activity / cell adhesion / positive regulation of cell migration / apical plasma membrane / structural molecule activity / extracellular region / identical protein binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 | other entries (その他) /  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
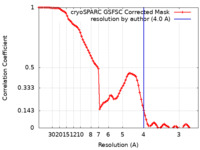
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.0 Å | |||||||||
 データ登録者 データ登録者 | Vecchio AJ | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2024 ジャーナル: Structure / 年: 2024タイトル: Cryo-EM structures of Clostridium perfringens enterotoxin bound to its human receptor, claudin-4. 著者: Sewwandi S Rathnayake / Satchal K Erramilli / Anthony A Kossiakoff / Alex J Vecchio /  要旨: Clostridium perfringens enterotoxin (CpE) causes prevalent and deadly gastrointestinal disorders. CpE binds to receptors called claudins on the apical surfaces of small intestinal epithelium. ...Clostridium perfringens enterotoxin (CpE) causes prevalent and deadly gastrointestinal disorders. CpE binds to receptors called claudins on the apical surfaces of small intestinal epithelium. Claudins normally regulate paracellular transport but are hijacked from doing so by CpE and are instead led to form claudin/CpE complexes. Claudin/CpE complexes are the building blocks of oligomeric β-barrel pores that penetrate the plasma membrane and induce gut cytotoxicity. Here, we present the structures of CpE in complex with its native claudin receptor in humans, claudin-4, using cryogenic electron microscopy. The structures reveal the architecture of the claudin/CpE complex, the residues used in binding, the orientation of CpE relative to the membrane, and CpE-induced changes to claudin-4. Further, structures and modeling allude to the biophysical procession from claudin/CpE complexes to cytotoxic β-barrel pores during pathogenesis. In full, this work proposes a model of claudin/CpE assembly and provides strategies to obstruct its formation to treat CpE diseases. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_45748.map.gz emd_45748.map.gz | 30.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-45748-v30.xml emd-45748-v30.xml emd-45748.xml emd-45748.xml | 19.6 KB 19.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_45748_fsc.xml emd_45748_fsc.xml | 8.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_45748.png emd_45748.png | 66.1 KB | ||
| Filedesc metadata |  emd-45748.cif.gz emd-45748.cif.gz | 6.3 KB | ||
| その他 |  emd_45748_half_map_1.map.gz emd_45748_half_map_1.map.gz emd_45748_half_map_2.map.gz emd_45748_half_map_2.map.gz | 56.7 MB 56.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-45748 http://ftp.pdbj.org/pub/emdb/structures/EMD-45748 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45748 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45748 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_45748_validation.pdf.gz emd_45748_validation.pdf.gz | 865.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_45748_full_validation.pdf.gz emd_45748_full_validation.pdf.gz | 864.7 KB | 表示 | |
| XML形式データ |  emd_45748_validation.xml.gz emd_45748_validation.xml.gz | 16.1 KB | 表示 | |
| CIF形式データ |  emd_45748_validation.cif.gz emd_45748_validation.cif.gz | 20.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45748 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45748 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45748 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45748 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9cmhM  9cmiC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_45748.map.gz / 形式: CCP4 / 大きさ: 61 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_45748.map.gz / 形式: CCP4 / 大きさ: 61 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.294 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_45748_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
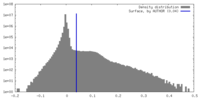
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_45748_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
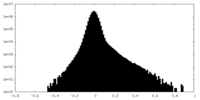
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human claudin-4 complex with Clostridium perfringens enterotoxin
| 全体 | 名称: Human claudin-4 complex with Clostridium perfringens enterotoxin |
|---|---|
| 要素 |
|
-超分子 #1: Human claudin-4 complex with Clostridium perfringens enterotoxin
| 超分子 | 名称: Human claudin-4 complex with Clostridium perfringens enterotoxin タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all / 詳細: 2-protein complex |
|---|---|
| 由来(天然) | 生物種: other entries (その他) |
| 分子量 | 理論値: 55 KDa |
-分子 #1: Claudin-4
| 分子 | 名称: Claudin-4 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 22.234332 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: GSMASMGLQV MGIALAVLGW LAVMLCCALP MWRVTAFIGS NIVTSQTIWE GLWMNCVVQS TGQMQCKVYD SLLALPQDLQ AARALVIIS IIVAALGVLL SVVGGKCTNC LEDESAKAKT MIVAGVVFLL AGLMVIVPVS WTAHNIIQDF YNPLVASGQK R EMGASLYV ...文字列: GSMASMGLQV MGIALAVLGW LAVMLCCALP MWRVTAFIGS NIVTSQTIWE GLWMNCVVQS TGQMQCKVYD SLLALPQDLQ AARALVIIS IIVAALGVLL SVVGGKCTNC LEDESAKAKT MIVAGVVFLL AGLMVIVPVS WTAHNIIQDF YNPLVASGQK R EMGASLYV GWAASGLLLL GGGLLCCNCP PRTDKPYSAK YSAARSAAAS NYV UniProtKB: Claudin-4 |
-分子 #2: Heat-labile enterotoxin B chain
| 分子 | 名称: Heat-labile enterotoxin B chain / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 33.000582 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: TPINITNSNS NLSDGLYVID KGDGWILGEP SVVSSQILNP NETGTFSQSL TKSKEVSINV NFSVGFTSEF IQASVEYGFG ITIGEQNTI ERSVSTTAGP NEYVYYKVYA TYRKYQAIRI SHGNISDDGS IYKLTGIWLS KTSADSLGNI DQGSLIETGE R CVLTVPST ...文字列: TPINITNSNS NLSDGLYVID KGDGWILGEP SVVSSQILNP NETGTFSQSL TKSKEVSINV NFSVGFTSEF IQASVEYGFG ITIGEQNTI ERSVSTTAGP NEYVYYKVYA TYRKYQAIRI SHGNISDDGS IYKLTGIWLS KTSADSLGNI DQGSLIETGE R CVLTVPST DIEKEILDLA AATERLNLTD ALNSNPAGNL YDWRSSNSYP WTQKLNLHLT ITATGQKYRI LASKIVDFNI YS NNFNNLV KLEQSLGDGV KDHYVDISLD AGQYVLVMKA NSSYSGNYPY SILFQKFGLV PR UniProtKB: Heat-labile enterotoxin B chain |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 8.0 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
詳細: 20 mM Hepes pH 7.4, 100 mM NaCl, and 0.003% LMNG | ||||||||||||
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. 詳細: glow-discharged for 60 seconds at 15 mA using a Pelco easiGlow (Ted Pella Inc) instrument. | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum |
| ソフトウェア | 名称: SerialEM |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOCONTINUUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 7100 / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 129000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)