+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the human CLC-2 chloride channel transmembrane domain with bound inhibitor AK-42 | |||||||||||||||
 マップデータ マップデータ | ||||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード |  Chloride (塩化物) / Channel / Inhibitor / Chloride (塩化物) / Channel / Inhibitor /  Protein (タンパク質) / Voltage gated / TRANSPORT PROTEIN-INHIBITOR complex Protein (タンパク質) / Voltage gated / TRANSPORT PROTEIN-INHIBITOR complex | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of aldosterone biosynthetic process / cell differentiation involved in salivary gland development / acinar cell differentiation / voltage-gated chloride channel activity / chloride transport / positive regulation of oligodendrocyte differentiation /  chloride channel complex / lung development / Stimuli-sensing channels / retina development in camera-type eye ...regulation of aldosterone biosynthetic process / cell differentiation involved in salivary gland development / acinar cell differentiation / voltage-gated chloride channel activity / chloride transport / positive regulation of oligodendrocyte differentiation / chloride channel complex / lung development / Stimuli-sensing channels / retina development in camera-type eye ...regulation of aldosterone biosynthetic process / cell differentiation involved in salivary gland development / acinar cell differentiation / voltage-gated chloride channel activity / chloride transport / positive regulation of oligodendrocyte differentiation /  chloride channel complex / lung development / Stimuli-sensing channels / retina development in camera-type eye / chloride channel complex / lung development / Stimuli-sensing channels / retina development in camera-type eye /  perikaryon / perikaryon /  樹状突起 / 樹状突起 /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.74 Å クライオ電子顕微鏡法 / 解像度: 2.74 Å | |||||||||||||||
 データ登録者 データ登録者 | Xu M / Neelands T / Powers AS / Liu Y / Miller S / Pintilie G / Du Bois J / Dror RO / Chiu W / Maduke M | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2024 ジャーナル: Elife / 年: 2024タイトル: CryoEM structures of the human CLC-2 voltage-gated chloride channel reveal a ball-and-chain gating mechanism. 著者: Mengyuan Xu / Torben Neelands / Alexander S Powers / Yan Liu / Steven D Miller / Grigore D Pintilie / J Du Bois / Ron O Dror / Wah Chiu / Merritt Maduke /  要旨: CLC-2 is a voltage-gated chloride channel that contributes to electrical excitability and ion homeostasis in many different tissues. Among the nine mammalian CLC homologs, CLC-2 is uniquely activated ...CLC-2 is a voltage-gated chloride channel that contributes to electrical excitability and ion homeostasis in many different tissues. Among the nine mammalian CLC homologs, CLC-2 is uniquely activated by hyperpolarization, rather than depolarization, of the plasma membrane. The molecular basis for the divergence in polarity of voltage gating among closely related homologs has been a long-standing mystery, in part because few CLC channel structures are available. Here, we report cryoEM structures of human CLC-2 at 2.46 - 2.76 Å, in the presence and absence of the selective inhibitor AK-42. AK-42 binds within the extracellular entryway of the Cl-permeation pathway, occupying a pocket previously proposed through computational docking studies. In the apo structure, we observed two distinct conformations involving rotation of one of the cytoplasmic C-terminal domains (CTDs). In the absence of CTD rotation, an intracellular N-terminal 15-residue hairpin peptide nestles against the TM domain to physically occlude the Cl-permeation pathway. This peptide is highly conserved among species variants of CLC-2 but is not present in other CLC homologs. Previous studies suggested that the N-terminal domain of CLC-2 influences channel properties via a "ball-and-chain" gating mechanism, but conflicting data cast doubt on such a mechanism, and thus the structure of the N-terminal domain and its interaction with the channel has been uncertain. Through electrophysiological studies of an N-terminal deletion mutant lacking the 15-residue hairpin peptide, we support a model in which the N-terminal hairpin of CLC-2 stabilizes a closed state of the channel by blocking the cytoplasmic Cl-permeation pathway. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_41126.map.gz emd_41126.map.gz | 59.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-41126-v30.xml emd-41126-v30.xml emd-41126.xml emd-41126.xml | 18.5 KB 18.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_41126.png emd_41126.png | 129.4 KB | ||
| Filedesc metadata |  emd-41126.cif.gz emd-41126.cif.gz | 6.3 KB | ||
| その他 |  emd_41126_half_map_1.map.gz emd_41126_half_map_1.map.gz emd_41126_half_map_2.map.gz emd_41126_half_map_2.map.gz | 59 MB 59 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-41126 http://ftp.pdbj.org/pub/emdb/structures/EMD-41126 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41126 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41126 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_41126.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_41126.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.946 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
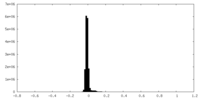
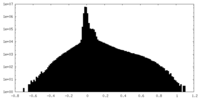
| ファイル | emd_41126_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
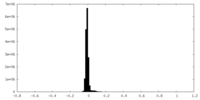
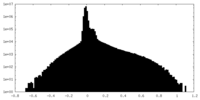
| ファイル | emd_41126_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Chloride channel protein 2 with inhibitor AK-42
| 全体 | 名称: Chloride channel protein 2 with inhibitor AK-42 クロライドチャネル クロライドチャネル |
|---|---|
| 要素 |
|
-超分子 #1: Chloride channel protein 2 with inhibitor AK-42
| 超分子 | 名称: Chloride channel protein 2 with inhibitor AK-42 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Chloride channel protein 2
| 分子 | 名称: Chloride channel protein 2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 52.390672 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GEDWIFLVLL GLLMALVSWV MDYAIAACLQ AQQWMSRGLN TSILLQYLAW VTYPVVLITF SAGFTQILAP QAVGSGIPEM KTILRGVVL KEYLTLKTFI AKVIGLTCAL GSGMPLGKEG PFVHIASMCA ALLSKFLSLF GGIYENESRN TEMLAAACAV G VGCCFAAP ...文字列: GEDWIFLVLL GLLMALVSWV MDYAIAACLQ AQQWMSRGLN TSILLQYLAW VTYPVVLITF SAGFTQILAP QAVGSGIPEM KTILRGVVL KEYLTLKTFI AKVIGLTCAL GSGMPLGKEG PFVHIASMCA ALLSKFLSLF GGIYENESRN TEMLAAACAV G VGCCFAAP IGGVLFSIEV TSTFFAVRNY WRGFFAATFS AFIFRVLAVW NRDEETITAL FKTRFRLDFP FDLQELPAFA VI GIASGFG GALFVYLNRK IVQVMRKQKT INRFLMRKRL LFPALVTLLI STLTFPPGFG QFMAGQLSQK ETLVTLFDNR TWV RQGLVE ELEPPSTSQA WNPPRANVFL TLVIFILMKF WMSALATTIP VPCGAFMPVF VIGAAFGRLV GESMAAWFPD GIHT DSSTY RIVPGGYAVV GAAALAGAVT HTVSTAVIVF ELTGQIAHIL PVMIAVILAN AVAQSLQPSL YDSIIRIKKL PYLP UniProtKB:  Chloride channel protein 2 Chloride channel protein 2 |
-分子 #2: 2-[[2,6-bis(chloranyl)-3-phenylmethoxy-phenyl]amino]pyridine-3-ca...
| 分子 | 名称: 2-[[2,6-bis(chloranyl)-3-phenylmethoxy-phenyl]amino]pyridine-3-carboxylic acid タイプ: ligand / ID: 2 / コピー数: 2 / 式: GH6 |
|---|---|
| 分子量 | 理論値: 389.232 Da |
| Chemical component information | 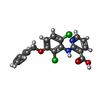 ChemComp-GH6: |
-分子 #3: CHLORIDE ION
| 分子 | 名称: CHLORIDE ION / タイプ: ligand / ID: 3 / コピー数: 2 / 式: CL |
|---|---|
| 分子量 | 理論値: 35.453 Da |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 実像数: 14300 / 平均露光時間: 5.6 sec. / 平均電子線量: 50.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 5214695 |
|---|---|
| 初期モデル | モデルのタイプ: NONE |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC (ver. 3.2) |
| 最終 3次元分類 | クラス数: 10 / ソフトウェア - 名称: cryoSPARC (ver. 3.2) |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC (ver. 3.2) |
| 最終 再構成 | 使用したクラス数: 10 / 解像度のタイプ: BY AUTHOR / 解像度: 2.74 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC (ver. 3.2) / 使用した粒子像数: 2391813 |
 ムービー
ムービー コントローラー
コントローラー














 Z
Z Y
Y X
X