+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
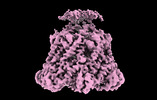
| タイトル | ATP-1 state of Bcs1 (C7 symmetrized) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Heptamer / AAA-ATPase / ATP-bound / Translocase | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報mitochondrial protein-transporting ATPase activity / protein insertion into mitochondrial inner membrane from matrix / mitochondrial cytochrome c oxidase assembly / mitochondrial respiratory chain complex III assembly / mitochondrial respiratory chain complex I assembly / mitochondrial inner membrane / ATP hydrolysis activity / mitochondrion / ATP binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
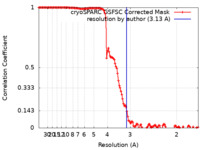
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.13 Å | |||||||||
 データ登録者 データ登録者 | Zhan J / Xia D | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Conformations of Bcs1L undergoing ATP hydrolysis suggest a concerted translocation mechanism for folded iron-sulfur protein substrate. 著者: Jingyu Zhan / Allison Zeher / Rick Huang / Wai Kwan Tang / Lisa M Jenkins / Di Xia /  要旨: The human AAA-ATPase Bcs1L translocates the fully assembled Rieske iron-sulfur protein (ISP) precursor across the mitochondrial inner membrane, enabling respiratory Complex III assembly. Exactly how ...The human AAA-ATPase Bcs1L translocates the fully assembled Rieske iron-sulfur protein (ISP) precursor across the mitochondrial inner membrane, enabling respiratory Complex III assembly. Exactly how the folded substrate is bound to and released from Bcs1L has been unclear, and there has been ongoing debate as to whether subunits of Bcs1L act in sequence or in unison hydrolyzing ATP when moving the protein cargo. Here, we captured Bcs1L conformations by cryo-EM during active ATP hydrolysis in the presence or absence of ISP substrate. In contrast to the threading mechanism widely employed by AAA proteins in substrate translocation, subunits of Bcs1L alternate uniformly between ATP and ADP conformations without detectable intermediates that have different, co-existing nucleotide states, indicating that the subunits act in concert. We further show that the ISP can be trapped by Bcs1 when its subunits are all in the ADP-bound state, which we propose to be released in the apo form. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
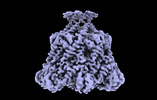
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_41061.map.gz emd_41061.map.gz | 200 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-41061-v30.xml emd-41061-v30.xml emd-41061.xml emd-41061.xml | 17 KB 17 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_41061_fsc.xml emd_41061_fsc.xml | 14.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_41061.png emd_41061.png | 86.7 KB | ||
| Filedesc metadata |  emd-41061.cif.gz emd-41061.cif.gz | 5.8 KB | ||
| その他 |  emd_41061_additional_1.map.gz emd_41061_additional_1.map.gz emd_41061_half_map_1.map.gz emd_41061_half_map_1.map.gz emd_41061_half_map_2.map.gz emd_41061_half_map_2.map.gz | 200.7 MB 185.6 MB 185.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-41061 http://ftp.pdbj.org/pub/emdb/structures/EMD-41061 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41061 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41061 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_41061_validation.pdf.gz emd_41061_validation.pdf.gz | 910.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_41061_full_validation.pdf.gz emd_41061_full_validation.pdf.gz | 909.7 KB | 表示 | |
| XML形式データ |  emd_41061_validation.xml.gz emd_41061_validation.xml.gz | 21.4 KB | 表示 | |
| CIF形式データ |  emd_41061_validation.cif.gz emd_41061_validation.cif.gz | 27.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41061 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41061 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41061 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41061 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8t5uMC  8t14C  8t7uC  8tbyC  8ti0C  8tp1C  8tplC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_41061.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_41061.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.858 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: #1
| ファイル | emd_41061_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
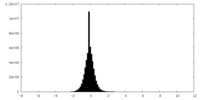
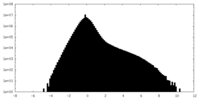
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_41061_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_41061_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Heptameric Bcs1 in uniform ATP-bound state captured during active...
| 全体 | 名称: Heptameric Bcs1 in uniform ATP-bound state captured during active ATPase cycle |
|---|---|
| 要素 |
|
-超分子 #1: Heptameric Bcs1 in uniform ATP-bound state captured during active...
| 超分子 | 名称: Heptameric Bcs1 in uniform ATP-bound state captured during active ATPase cycle タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 340 KDa |
-分子 #1: Mitochondrial chaperone BCS1
| 分子 | 名称: Mitochondrial chaperone BCS1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 7 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 48.659281 KDa |
| 組換発現 | 生物種:  Komagataella pastoris (菌類) Komagataella pastoris (菌類) |
| 配列 | 文字列: MPFSDFVLAL KDNPYFGAGF GLVGVGTALA MARKGAQLGL VAFRRHYMIT LEVPARDRSY AWLLSWLTRH STRTQHLSVE TSYLQHESG RISTKFEFIP SPGNHFIWYQ GKWIRVERNR DMQMVDLQTG TPWESVTFTA LGTDRKVFFN ILEEARALAL Q QEEGKTVM ...文字列: MPFSDFVLAL KDNPYFGAGF GLVGVGTALA MARKGAQLGL VAFRRHYMIT LEVPARDRSY AWLLSWLTRH STRTQHLSVE TSYLQHESG RISTKFEFIP SPGNHFIWYQ GKWIRVERNR DMQMVDLQTG TPWESVTFTA LGTDRKVFFN ILEEARALAL Q QEEGKTVM YTAVGSEWRT FGYPRRRRPL DSVVLQQGLA DRIVKDIREF IDNPKWYIDR GIPYRRGYLL YGPPGCGKSS FI TALAGEL EHSICLLSLT DSSLSDDRLN HLLSVAPQQS LVLLEDVDAA FLSRDLAVEN PIKYQGLGRL TFSGLLNALD GVA STEARI VFMTTNYIDR LDPALIRPGR VDLKEYVGYC SHWQLTQMFQ RFYPGQAPSL AENFAEHVLK ATSEISPAQV QGYF MLYKN DPMGAVHNIE SLRPRDHHHH HH UniProtKB: Mitochondrial chaperone BCS1 |
-分子 #2: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 2 / コピー数: 7 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #3: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 7 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z
Z Y
Y X
X