+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | E1435Q Ycf1 mutant in dephosphorylated state | |||||||||
 マップデータ マップデータ | Sharpened cryosparc map used for model building and refinement. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ABC transporter / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ABC-type Cd2+ transporter / ABC-type cadmium transporter activity / Recycling of bile acids and salts / Heme degradation / Aspirin ADME / Paracetamol ADME / Atorvastatin ADME / P-type cadmium transporter activity / bilirubin transmembrane transporter activity / bilirubin transport ...ABC-type Cd2+ transporter / ABC-type cadmium transporter activity / Recycling of bile acids and salts / Heme degradation / Aspirin ADME / Paracetamol ADME / Atorvastatin ADME / P-type cadmium transporter activity / bilirubin transmembrane transporter activity / bilirubin transport / ABC-family proteins mediated transport / vacuole fusion, non-autophagic / ABC-type glutathione-S-conjugate transporter / ABC-type glutathione S-conjugate transporter activity / fungal-type vacuole membrane / response to metal ion / ATPase-coupled transmembrane transporter activity / response to cadmium ion / glutathione metabolic process / cell redox homeostasis / transmembrane transport / ATP hydrolysis activity / ATP binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |   | |||||||||
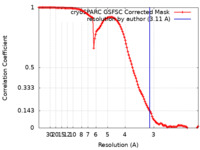
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.11 Å | |||||||||
 データ登録者 データ登録者 | Khandelwal NK / Tomasiak TM | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: E1435Q Ycf1 mutant in dephosphorylated state 著者: Khandelwal NK / Tomasiak TM | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_40451.map.gz emd_40451.map.gz | 168.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-40451-v30.xml emd-40451-v30.xml emd-40451.xml emd-40451.xml | 20.3 KB 20.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_40451_fsc.xml emd_40451_fsc.xml | 11.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_40451.png emd_40451.png | 69.6 KB | ||
| Filedesc metadata |  emd-40451.cif.gz emd-40451.cif.gz | 7.1 KB | ||
| その他 |  emd_40451_additional_1.map.gz emd_40451_additional_1.map.gz emd_40451_half_map_1.map.gz emd_40451_half_map_1.map.gz emd_40451_half_map_2.map.gz emd_40451_half_map_2.map.gz | 89.5 MB 165.4 MB 165.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-40451 http://ftp.pdbj.org/pub/emdb/structures/EMD-40451 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40451 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40451 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_40451_validation.pdf.gz emd_40451_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_40451_full_validation.pdf.gz emd_40451_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_40451_validation.xml.gz emd_40451_validation.xml.gz | 20.5 KB | 表示 | |
| CIF形式データ |  emd_40451_validation.cif.gz emd_40451_validation.cif.gz | 26.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40451 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40451 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40451 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40451 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8sg4MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_40451.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_40451.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened cryosparc map used for model building and refinement. | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.0694 Å | ||||||||||||||||||||
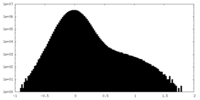
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Unsharpened cryosparc map.
| ファイル | emd_40451_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened cryosparc map. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
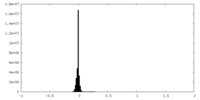
| 密度ヒストグラム |
-ハーフマップ: Half map 1 from cryosparc reconstruction used in...
| ファイル | emd_40451_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 from cryosparc reconstruction used in final model building and refinement. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
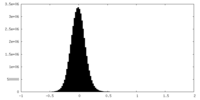
| 密度ヒストグラム |
-ハーフマップ: Half map 2 from cryosparc reconstruction used in...
| ファイル | emd_40451_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 from cryosparc reconstruction used in final model building and refinement. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
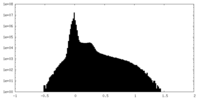
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Ycf1
| 全体 | 名称: Ycf1 |
|---|---|
| 要素 |
|
-超分子 #1: Ycf1
| 超分子 | 名称: Ycf1 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 176.66831 KDa |
-分子 #1: Metal resistance protein YCF1
| 分子 | 名称: Metal resistance protein YCF1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: ABC-type Cd2+ transporter |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 176.209594 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MASDYKDDDD KGALEVLFQG PSSPMAGNLV SWACKLCRSP EGFGPISFYG DFTQCFIDGV ILNLSAIFMI TFGIRDLVNL CKKKHSGIK YRRNWIIVSR MALVLLEIAF VSLASLNISK EEAENFTIVS QYASTMLSLF VALALHWIEY DRSVVANTVL L FYWLFETF ...文字列: MASDYKDDDD KGALEVLFQG PSSPMAGNLV SWACKLCRSP EGFGPISFYG DFTQCFIDGV ILNLSAIFMI TFGIRDLVNL CKKKHSGIK YRRNWIIVSR MALVLLEIAF VSLASLNISK EEAENFTIVS QYASTMLSLF VALALHWIEY DRSVVANTVL L FYWLFETF GNFAKLINIL IRHTYEGIWY SGQTGFILTL FQVITCASIL LLEALPKKPL MPHQHIHQTL TRRKPNPYDS AN IFSRITF SWMSGLMKTG YEKYLVEADL YKLPRNFSSE ELSQKLEKNW ENELKQKSNP SLSWAICRTF GSKMLLAAFF KAI HDVLAF TQPQLLRILI KFVTDYNSER QDDHSSLQGF ENNHPQKLPI VRGFLIAFAM FLVGFTQTSV LHQYFLNVFN TGMY IKSAL TALIYQKSLV LSNEASGLSS TGDIVNLMSV DVQKLQDLTQ WLNLIWSGPF QIIICLYSLY KLLGNSMWVG VIILV IMMP LNSFLMRIQK KLQKSQMKYK DERTRVISEI LNNIKSLKLY AWEKPYREKL EEVRNNKELK NLTKLGCYMA VTSFQF NIV PFLVSCCTFA VFVYTEDRAL TTDLVFPALT LFNLLSFPLM IIPMVLNSFI EASVSIGRLF TFFTNEELQP DSVQRLP KV KNIGDVAINI GDDATFLWQR KPEYKVALKN INFQAKKGNL TCIVGKVGSG KTALLSCMLG DLFRVKGFAT VHGSVAYV S QVPWIMNGTV KENILFGHRY DAEFYEKTIK ACALTIDLAI LMDGDKTLVG EKGISLSGGQ KARLSLARAV YARADTYLL DDPLAAVDEH VARHLIEHVL GPNGLLHTKT KVLATNKVSA LSIADSIALL DNGEITQQGT YDEITKDADS PLWKLLNNYG KKNNGKSNE FGDSSESSVR ESSIPVEGEL EQLQKLNDLD FGNSDAISLR RASDATLGSI DFGDDENIAK REHREQGKVK W NIYLEYAK ACNPKSVCVF ILFIVISMFL SVMGNVWLKH WSEVNSRYGS NPNAARYLAI YFALGIGSAL ATLIQTIVLW VF CTIHASK YLHNLMTNSV LRAPMTFFET TPIGRILNRF SNDIYKVDAL LGRTFSQFFV NAVKVTFTIT VICATTWQFI FII IPLSVF YIYYQQYYLR TSRELRRLDS ITRSPIYSHF QETLGGLATV RGYSQQKRFS HINQCRIDNN MSAFYPSINA NRWL AYRLE LIGSIIILGA ATLSVFRLKQ GTLTAGMVGL SLSYALQITQ TLNWIVRMTV EVETNIVSVE RIKEYADLKS EAPLI VEGH RPPKEWPSQG DIKFNNYSTR YRPELDLVLK HINIHIKPNE KVGIVGRTGA GKSSLTLALF RMIEASEGNI VIDNIA INE IGLYDLRHKL SIIPQDSQVF EGTVRENIDP INQYTDEAIW RALELSHLKE HVLSMSNDGL DAQLTEGGGN LSVGQRQ LL CLARAMLVPS KILVLDQATA AVDVETDKVV QETIRTAFKD RTILTIAHRL NTIMDSDRII VLDNGKVAEF DSPGQLLS D NKSLFYSLCM EAGLVNENGL VPRGSSAHHH HHHHHHHGA UniProtKB: Metal resistance protein YCF1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 10.56 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7 構成要素:
詳細: Solution were made fresh in cold distilled water and final pH was adjusted to 7.0 with HCl of cold buffer. The digitonin detergent was added to final .06 % in buffer after pH adjustment. | |||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 400 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 80 % / チャンバー内温度: 283.15 K / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 5904 / 平均露光時間: 3.0 sec. / 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 倍率(補正後): 81000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm 最大 デフォーカス(公称値): 1.9000000000000001 µm 最小 デフォーカス(公称値): 0.6 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー







 Z
Z Y
Y X
X