+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of TRPA1 in Drosophila melanogaster in a state with 17 ankyrin repeats determined | |||||||||||||||
 マップデータ マップデータ | ||||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | ion channel / TRPA1 / MEMBRANE PROTEIN | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cellular response to pulsatile fluid shear stress / temperature compensation of the circadian clock / negative phototaxis / detection of hot stimulus involved in thermoception / TRP channels / neuronal signal transduction / thermosensory behavior / temperature-gated cation channel activity / mechanosensory behavior / detection of chemical stimulus involved in sensory perception of bitter taste ...cellular response to pulsatile fluid shear stress / temperature compensation of the circadian clock / negative phototaxis / detection of hot stimulus involved in thermoception / TRP channels / neuronal signal transduction / thermosensory behavior / temperature-gated cation channel activity / mechanosensory behavior / detection of chemical stimulus involved in sensory perception of bitter taste / cation channel complex / detection of chemical stimulus involved in sensory perception of pain / thermotaxis / detection of temperature stimulus involved in thermoception / monoatomic cation transmembrane transport / monoatomic cation transport / detection of temperature stimulus involved in sensory perception of pain / phototransduction / ligand-gated monoatomic ion channel activity / response to light stimulus / monoatomic cation channel activity / positive regulation of calcium-mediated signaling / calcium channel activity / calcium ion transport / cellular response to heat / response to heat / membrane / plasma membrane 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||||||||
 データ登録者 データ登録者 | Sun L / Liu X / Yang Z / Wang X | |||||||||||||||
| 資金援助 |  中国, 4件 中国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Cell Discov / 年: 2023 ジャーナル: Cell Discov / 年: 2023タイトル: Molecular architecture and gating mechanisms of the Drosophila TRPA1 channel. 著者: Xiaofei Wang / Yawen Li / Hong Wei / Zhisen Yang / Rui Luo / Yongxiang Gao / Wei Zhang / Xin Liu / Linfeng Sun /  要旨: The transient receptor potential channel subfamily A member 1 (TRPA1) ion channel is an evolutionary conserved polymodal sensor responding to noxious temperature or chemical stimuli. Notably, the ...The transient receptor potential channel subfamily A member 1 (TRPA1) ion channel is an evolutionary conserved polymodal sensor responding to noxious temperature or chemical stimuli. Notably, the thermosensitivity of TRPA1 varies among different species or even different isoforms in the same species. However, the underlying molecular basis of its thermo-gating remains largely unknown. Here, we determine the structures of a heat-sensitive isoform of TRPA1 in Drosophila melanogaster in two distinct conformations with cryo-samples prepared at 8 °C. Large conformational changes are observed in the ankyrin repeat domain (ARD) and the coiled-coil domain between the two states. Remarkably, all 17 ankyrin repeats are mapped in the newly resolved conformation, forming a propeller-like architecture. Two intersubunit interfaces are identified in the amino (N)-terminal domain, and play vital roles during both heat and chemical activation as shown by electrophysiological analysis. With cryo-samples prepared at 35 °C, only one conformation is resolved, suggesting possible state transitions during heat responses. These findings provide a basis for further understanding how the ARD regulates channel functions, and insights into the gating mechanism of TRPA1. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33895.map.gz emd_33895.map.gz | 33 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33895-v30.xml emd-33895-v30.xml emd-33895.xml emd-33895.xml | 14.7 KB 14.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_33895_fsc.xml emd_33895_fsc.xml | 9.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_33895.png emd_33895.png | 121.9 KB | ||
| Filedesc metadata |  emd-33895.cif.gz emd-33895.cif.gz | 6 KB | ||
| その他 |  emd_33895_half_map_1.map.gz emd_33895_half_map_1.map.gz emd_33895_half_map_2.map.gz emd_33895_half_map_2.map.gz | 59.2 MB 59.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33895 http://ftp.pdbj.org/pub/emdb/structures/EMD-33895 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33895 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33895 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_33895_validation.pdf.gz emd_33895_validation.pdf.gz | 911.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_33895_full_validation.pdf.gz emd_33895_full_validation.pdf.gz | 910.8 KB | 表示 | |
| XML形式データ |  emd_33895_validation.xml.gz emd_33895_validation.xml.gz | 16.4 KB | 表示 | |
| CIF形式データ |  emd_33895_validation.cif.gz emd_33895_validation.cif.gz | 21.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33895 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33895 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33895 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33895 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7ykrMC  7yksC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33895.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33895.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.01 Å | ||||||||||||||||||||||||||||||||||||
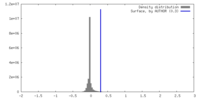
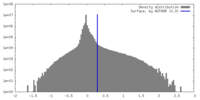
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_33895_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_33895_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Homotetramer of dTRPA1
| 全体 | 名称: Homotetramer of dTRPA1 |
|---|---|
| 要素 |
|
-超分子 #1: Homotetramer of dTRPA1
| 超分子 | 名称: Homotetramer of dTRPA1 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Transient receptor potential cation channel subfamily A member 1
| 分子 | 名称: Transient receptor potential cation channel subfamily A member 1 タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 135.324359 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MTSGDKETPK REDFASALRF LMGGCAREPE MTAMAPLNLP KKWARILRMS STPKIPIVDY LEAAESGNLD DFKRLFMADN SRIALKDAK GRTAAHQAAA RNRVNILRYI RDQNGDFNAK DNAGNTPLHI AVESDAYDAL DYLLSIPVDT GVLNEKKQAP V HLATELNK ...文字列: MTSGDKETPK REDFASALRF LMGGCAREPE MTAMAPLNLP KKWARILRMS STPKIPIVDY LEAAESGNLD DFKRLFMADN SRIALKDAK GRTAAHQAAA RNRVNILRYI RDQNGDFNAK DNAGNTPLHI AVESDAYDAL DYLLSIPVDT GVLNEKKQAP V HLATELNK VKSLRVMGQY RNVIDIQQGG EHGRTALHLA AIYDHEECAR ILITEFDACP RKPCNNGYYP IHEAAKNASS KT MEVFFQW GEQRGCTREE MISFYDSEGN VPLHSAVHGG DIKAVELCLK SGAKISTQQH DLSTPVHLAC AQGAIDIVKL MFE MQPMEK RLCLSCTDVQ KMTPLHCASM FDHPDIVSYL VAEGADINAL DKEHRSPLLL AASRSGWKTV HLLIRLGACI SVKD AAARN VLHFVIMNGG RLTDFAEQVA NCQTQAQLKL LLNEKDSMGC SPLHYASRDG HIRSLENLIR LGACINLKNN NNESP LHFA ARYGRYNTVR QLLDSEKGSF IINESDGAGM TPLHISSQQG HTRVVQLLLN RGALLHRDHT GRNPLQLAAM SGYTET IEL LHSVHSHLLD QVDKDGNTAL HLATMENKPH AISVLMSMGC KLVYNVLDMS AIDYAIYYKY PEAALAMVTH EERANEV MA LRSDKHPCVT LALIASMPKV FEAVQDKCIT KANCKKDSKS FYIKYSFAFL QCPFMFAKID EKTGESITTA SPIPLPAL N TMVTHGRVEL LAHPLSQKYL QMKWNSYGKY FHLANLLIYS IFLVFVTIYS SLMMNNIELK AGDNKTMSQY CNMGWEQLT MNLSQNPSVA SQIRLDSCEE RINRTTAILF CAVVIVVYIL LNSMRELIQI YQQKLHYILE TVNLISWVLY ISALVMVTPA FQPDGGINT IHYSAASIAV FLSWFRLLLF LQRFDQVGIY VVMFLEILQT LIKVLMVFSI LIIAFGLAFY ILLSKIIDPQ P NHLSFSNI PMSLLRTFSM MLGELDFVGT YVNTYYRDQL KVPMTSFLIL SVFMILMPIL LMNLLIGLAV GDIESVRRNA QL KRLAMQV VLHTELERKL PHVWLQRVDK MELIEYPNET KCKLGFCDFI LRKWFSNPFT EDSSMDVISF DNNDDYINAE LER QRRKLR DISRMLEQQH HLVRLIVQKM EIKTEADDVD EGISPNELRS VVGLRSAGGN RWNSPRVRNK LRAALSFNKS M UniProtKB: Transient receptor potential cation channel subfamily A member 1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: DIFFRACTION 最大 デフォーカス(公称値): 2.3000000000000003 µm 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)