+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Photobacterium phosphoreum fatty acid reductase complex LuxC-LuxE | |||||||||
 マップデータ マップデータ | EM map of Photobacterium phosphoreum fatty acid reductase complex LuxC-LuxE | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | fatty acid reductase / acyl-protein synthetase / acyl-CoA reductase / bacterial bioluminescenc / LUMINESCENT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報long-chain acyl-protein thioester reductase / long-chain fatty acid--protein ligase activity / long-chain-fatty-acyl-CoA reductase activity / acyl-CoA dehydrogenase activity / bioluminescence 類似検索 - 分子機能 | |||||||||
| 生物種 |  Photobacterium phosphoreum (バクテリア) Photobacterium phosphoreum (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.79 Å | |||||||||
 データ登録者 データ登録者 | Tian Q / Huo Y / Wang L | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2022 ジャーナル: J Biol Chem / 年: 2022タイトル: Cryo-EM structure of the fatty acid reductase LuxC-LuxE complex provides insights into bacterial bioluminescence. 著者: Qingwei Tian / Jingting Wu / Haifeng Xu / Zhangli Hu / Yangao Huo / Liyan Wang /  要旨: The discovery of reduced flavin mononucleotide and fatty aldehydes as essential factors of light emission facilitated study of bacterial luminescence. Although the molecular mechanisms underlying ...The discovery of reduced flavin mononucleotide and fatty aldehydes as essential factors of light emission facilitated study of bacterial luminescence. Although the molecular mechanisms underlying bacterial luminescence have been studied for more than 60 years, the structure of the bacterial fatty acid reductase complex remains unclear. Here, we report the cryo-EM structure of the Photobacterium phosphoreum fatty acid reductase complex LuxC-LuxE to a resolution of 2.79 Å. We show that the active site Lys238/Arg355 pair of LuxE is >30 Å from the active site Cys296 of LuxC, implying that catalysis relies on a large conformational change. Furthermore, mutagenesis and biochemical experiments support that the L-shaped cleft inside LuxC plays an important role in substrate binding and reaction. We obtained a series of mutants with significantly improved activity as measured by in vitro bioluminescence assays and demonstrated that the double mutant W111A/F483K displayed the highest activity (370% of the WT). Our results indicated that the activity of LuxC significantly affects the bacterial bioluminescence reaction. Finally, we expressed this mutated lux operon in Escherichia coli but observed that the in vivo concentrations of ATP and NADPH limited the enzyme activity; thus, we conclude that the luminous intensity mainly depends on the level of metabolic energy. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33113.map.gz emd_33113.map.gz | 140.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33113-v30.xml emd-33113-v30.xml emd-33113.xml emd-33113.xml | 15.7 KB 15.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_33113.png emd_33113.png | 30.3 KB | ||
| Filedesc metadata |  emd-33113.cif.gz emd-33113.cif.gz | 5.7 KB | ||
| その他 |  emd_33113_half_map_1.map.gz emd_33113_half_map_1.map.gz emd_33113_half_map_2.map.gz emd_33113_half_map_2.map.gz | 118.4 MB 118.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33113 http://ftp.pdbj.org/pub/emdb/structures/EMD-33113 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33113 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33113 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_33113_validation.pdf.gz emd_33113_validation.pdf.gz | 986 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_33113_full_validation.pdf.gz emd_33113_full_validation.pdf.gz | 985.6 KB | 表示 | |
| XML形式データ |  emd_33113_validation.xml.gz emd_33113_validation.xml.gz | 14.1 KB | 表示 | |
| CIF形式データ |  emd_33113_validation.cif.gz emd_33113_validation.cif.gz | 16.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33113 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33113 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33113 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33113 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7xc6MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33113.map.gz / 形式: CCP4 / 大きさ: 149.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33113.map.gz / 形式: CCP4 / 大きさ: 149.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | EM map of Photobacterium phosphoreum fatty acid reductase complex LuxC-LuxE | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.833 Å | ||||||||||||||||||||||||||||||||||||
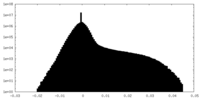
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: EM 2 half map of Photobacterium phosphoreum fatty...
| ファイル | emd_33113_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | EM 2 half map of Photobacterium phosphoreum fatty acid reductase complex LuxC-LuxE | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
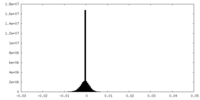
| 密度ヒストグラム |
-ハーフマップ: EM half map of Photobacterium phosphoreum fatty acid...
| ファイル | emd_33113_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | EM half map of Photobacterium phosphoreum fatty acid reductase complex LuxC-LuxE | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
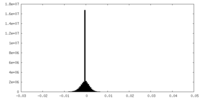
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : fatty acid reductase complex
| 全体 | 名称: fatty acid reductase complex |
|---|---|
| 要素 |
|
-超分子 #1: fatty acid reductase complex
| 超分子 | 名称: fatty acid reductase complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Photobacterium phosphoreum (バクテリア) Photobacterium phosphoreum (バクテリア) |
-分子 #1: LuxE
| 分子 | 名称: LuxE / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Photobacterium phosphoreum (バクテリア) Photobacterium phosphoreum (バクテリア) |
| 分子量 | 理論値: 42.934445 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTITLDICEK DIIVSTEIDD IIFTSSPLDI TYDEQERIKH KLILESFRYH YNNNEDYKSF CNTQGVDENI SSLDDIPVFP TSMFKYAKI CTADESNIEN WFTSSGTSGV KSHIARDRVS IERLLGSVNY GMKYLGSFHE NQLELVNMGP DRFNAKNVWF K YVMSLVEL ...文字列: MTITLDICEK DIIVSTEIDD IIFTSSPLDI TYDEQERIKH KLILESFRYH YNNNEDYKSF CNTQGVDENI SSLDDIPVFP TSMFKYAKI CTADESNIEN WFTSSGTSGV KSHIARDRVS IERLLGSVNY GMKYLGSFHE NQLELVNMGP DRFNAKNVWF K YVMSLVEL LYPTTFTVNN DEIDFELTIK SLKEIYNKGK GICLIGPPYF IYLLCQYMKE NDIEFNAGNR IFIITGGGWK TK QKQALNR QDFNQLLMET FHLAHESQIR DTFNQVELNT CFFEDNRQRK HVPPWVYARA LDPVTLKPVE DGQEGLISYM DAS STSYPT FIVTDDIGII HTIKAPDPHQ GTTIDIVRRL NTREQKGCSL SMSSGLK UniProtKB: LuxE |
-分子 #2: Long-chain acyl-protein thioester reductase
| 分子 | 名称: Long-chain acyl-protein thioester reductase / タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO / EC番号: long-chain acyl-protein thioester reductase |
|---|---|
| 由来(天然) | 生物種:  Photobacterium phosphoreum (バクテリア) Photobacterium phosphoreum (バクテリア) |
| 分子量 | 理論値: 54.067164 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: IKKIPMIIGG AERDTSEHEY RELTLNSYKV SIPIINQDDV EAIKSQSVEN NLNINQIVNF LYTVGQKWKS ENYSRRLTYI RDLVRFLGY SPEMAKLEAN WISMILSSKS ALYDIVETEL GSRHIVDEWL PQGDCYVKAM PKGKSVHLLA GNVPLSGVTS I IRAILTKN ...文字列: IKKIPMIIGG AERDTSEHEY RELTLNSYKV SIPIINQDDV EAIKSQSVEN NLNINQIVNF LYTVGQKWKS ENYSRRLTYI RDLVRFLGY SPEMAKLEAN WISMILSSKS ALYDIVETEL GSRHIVDEWL PQGDCYVKAM PKGKSVHLLA GNVPLSGVTS I IRAILTKN ECIIKTSSAD PFTAIALASS FIDTDEHHPI SRSMSVMYWS HNEDIAIPQQ IMNCADVVVS WGGYDAIKWA TE HTPVNVD ILKFGPKKSI AIVDNPVDIT ASAIGVAHDI CFYDQQACFS TQDIYYIGDN IDAFFDELVE QLNLYMDILP KGD QTFDEK ASFSLIEKEC QFAKYKVEKG DNQSWLLVKS PLGSFGNQPL ARSAYIHHVS DISEITPYIE NRITQTVTVT PWES SFKYR DVLASHGAER IVESGMNNIF RVGGAHDGMR PLQRLVKYIS HERPYTYSTK DVAVKIEQTR YLEEDKFLVF VP UniProtKB: Long-chain acyl-protein thioester reductase |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 40 sec. / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 2.79 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 229033 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
|---|---|
| 得られたモデル |  PDB-7xc6: |
 ムービー
ムービー コントローラー
コントローラー






 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)