+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of synthetic tau repeat R1R2 with two acetylated lysines at positions 274 and 280 | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Amyloid motif / acetylation / tau / repeat domain / post-translational modification / PROTEIN FIBRIL | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報plus-end-directed organelle transport along microtubule / axonal transport / histone-dependent DNA binding / neurofibrillary tangle assembly / positive regulation of diacylglycerol kinase activity / negative regulation of establishment of protein localization to mitochondrion / neurofibrillary tangle / positive regulation of protein localization to synapse / microtubule lateral binding / tubulin complex ...plus-end-directed organelle transport along microtubule / axonal transport / histone-dependent DNA binding / neurofibrillary tangle assembly / positive regulation of diacylglycerol kinase activity / negative regulation of establishment of protein localization to mitochondrion / neurofibrillary tangle / positive regulation of protein localization to synapse / microtubule lateral binding / tubulin complex / phosphatidylinositol bisphosphate binding / main axon / regulation of long-term synaptic depression / negative regulation of kinase activity / negative regulation of tubulin deacetylation / generation of neurons / positive regulation of protein localization / rRNA metabolic process / internal protein amino acid acetylation / regulation of chromosome organization / regulation of mitochondrial fission / intracellular distribution of mitochondria / axonal transport of mitochondrion / axon development / central nervous system neuron development / regulation of microtubule polymerization / microtubule polymerization / minor groove of adenine-thymine-rich DNA binding / lipoprotein particle binding / dynactin binding / apolipoprotein binding / glial cell projection / negative regulation of mitochondrial membrane potential / protein polymerization / axolemma / negative regulation of mitochondrial fission / Caspase-mediated cleavage of cytoskeletal proteins / regulation of microtubule polymerization or depolymerization / positive regulation of axon extension / regulation of microtubule cytoskeleton organization / Activation of AMPK downstream of NMDARs / supramolecular fiber organization / regulation of cellular response to heat / stress granule assembly / cytoplasmic microtubule organization / regulation of calcium-mediated signaling / axon cytoplasm / positive regulation of microtubule polymerization / somatodendritic compartment / synapse assembly / cellular response to brain-derived neurotrophic factor stimulus / phosphatidylinositol binding / nuclear periphery / cellular response to nerve growth factor stimulus / positive regulation of superoxide anion generation / protein phosphatase 2A binding / regulation of autophagy / astrocyte activation / response to lead ion / microglial cell activation / synapse organization / Hsp90 protein binding / regulation of synaptic plasticity / PKR-mediated signaling / protein homooligomerization / memory / microtubule cytoskeleton organization / cellular response to reactive oxygen species / SH3 domain binding / cytoplasmic ribonucleoprotein granule / activation of cysteine-type endopeptidase activity involved in apoptotic process / microtubule cytoskeleton / neuron projection development / cell-cell signaling / protein-macromolecule adaptor activity / actin binding / single-stranded DNA binding / cellular response to heat / protein-folding chaperone binding / cell body / growth cone / microtubule binding / double-stranded DNA binding / microtubule / amyloid fibril formation / sequence-specific DNA binding / dendritic spine / learning or memory / nuclear speck / neuron projection / membrane raft / axon / negative regulation of gene expression / neuronal cell body / dendrite / DNA damage response / protein kinase binding / enzyme binding / mitochondrion / DNA binding 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
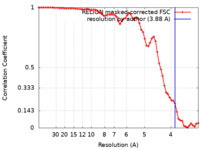
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.88 Å | ||||||||||||
 データ登録者 データ登録者 | Li L / Nguyen B / Mullapudi V / Saelices L / Joachimiak L | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2023 ジャーナル: Structure / 年: 2023タイトル: Disease-associated patterns of acetylation stabilize tau fibril formation. 著者: Li Li / Binh A Nguyen / Vishruth Mullapudi / Yang Li / Lorena Saelices / Lukasz A Joachimiak /  要旨: Assembly of tau into beta-sheet-rich amyloids dictates the pathology of a diversity of diseases. Lysine acetylation has been proposed to drive tau amyloid assembly, but no direct mechanism has ...Assembly of tau into beta-sheet-rich amyloids dictates the pathology of a diversity of diseases. Lysine acetylation has been proposed to drive tau amyloid assembly, but no direct mechanism has emerged. Using tau fragments, we identify patterns of acetylation that flank amyloidogenic motifs on the tau fragments that promote rapid fibril assembly. We determined a 3.9 Å cryo-EM amyloid fibril structure assembled from an acetylated tau fragment uncovering how lysine acetylation can mediate gain-of-function interactions. Comparison of the structure to an ex vivo tauopathy fibril reveals regions of structural similarity. Finally, we show that fibrils encoding disease-associated patterns of acetylation are active in cell-based tau aggregation assays. Our data uncover the dual role of lysine residues in limiting tau aggregation while their acetylation leads to stabilizing pro-aggregation interactions. Design of tau sequence with specific acetylation patterns may lead to controllable tau aggregation to direct folding of tau into distinct amyloid folds. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_28721.map.gz emd_28721.map.gz | 2.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-28721-v30.xml emd-28721-v30.xml emd-28721.xml emd-28721.xml | 17.9 KB 17.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_28721_fsc.xml emd_28721_fsc.xml | 6.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_28721.png emd_28721.png | 60 KB | ||
| マスクデータ |  emd_28721_msk_1.map emd_28721_msk_1.map | 22.2 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-28721.cif.gz emd-28721.cif.gz | 4.7 KB | ||
| その他 |  emd_28721_additional_1.map.gz emd_28721_additional_1.map.gz emd_28721_half_map_1.map.gz emd_28721_half_map_1.map.gz emd_28721_half_map_2.map.gz emd_28721_half_map_2.map.gz | 16.8 MB 16.9 MB 16.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-28721 http://ftp.pdbj.org/pub/emdb/structures/EMD-28721 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28721 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28721 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_28721_validation.pdf.gz emd_28721_validation.pdf.gz | 736.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_28721_full_validation.pdf.gz emd_28721_full_validation.pdf.gz | 736.2 KB | 表示 | |
| XML形式データ |  emd_28721_validation.xml.gz emd_28721_validation.xml.gz | 11.9 KB | 表示 | |
| CIF形式データ |  emd_28721_validation.cif.gz emd_28721_validation.cif.gz | 16.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28721 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28721 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28721 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28721 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8fnzMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_28721.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_28721.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.66 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_28721_msk_1.map emd_28721_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
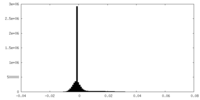
| 密度ヒストグラム |
-追加マップ: #1
| ファイル | emd_28721_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
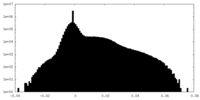
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_28721_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
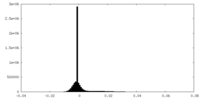
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_28721_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
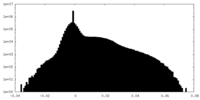
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Acetylated tau repeat 1 and 2 fragment (AcR1R2)
| 全体 | 名称: Acetylated tau repeat 1 and 2 fragment (AcR1R2) |
|---|---|
| 要素 |
|
-超分子 #1: Acetylated tau repeat 1 and 2 fragment (AcR1R2)
| 超分子 | 名称: Acetylated tau repeat 1 and 2 fragment (AcR1R2) / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Synthetic tau repeat R1R2 with two acetylated lysines at position 274 and 280 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / Synthetically produced: Yes Homo sapiens (ヒト) / Synthetically produced: Yes |
-分子 #1: Acetylated tau repeat 1 and 2 fragment (AcR1R2)
| 分子 | 名称: Acetylated tau repeat 1 and 2 fragment (AcR1R2) / タイプ: protein_or_peptide / ID: 1 / 詳細: (ALY): Acetylated lysine / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: TENLKHQPGG G(ALY)VQIIN(ALY) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 / 詳細: PBS |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: OTHER |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 295 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 5901 / 平均露光時間: 4.5 sec. / 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー









 Z
Z Y
Y X
X