+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | PaFS prenyltransferase core with single interacting cyclase domain - West class B | |||||||||
 マップデータ マップデータ | PaFS prenyltransferase core with single interacting cyclase domain - West class B | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Diaporthe amygdali (菌類) Diaporthe amygdali (菌類) | |||||||||
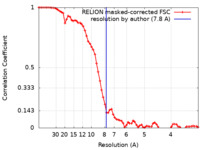
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 7.8 Å | |||||||||
 データ登録者 データ登録者 | Faylo JL / van Eeuwen T / Christianson DW | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 2022 ジャーナル: Biochemistry / 年: 2022タイトル: Transient Prenyltransferase-Cyclase Association in Fusicoccadiene Synthase, an Assembly-Line Terpene Synthase. 著者: Jacque L Faylo / Trevor van Eeuwen / Kushol Gupta / Kenji Murakami / David W Christianson /  要旨: Fusicoccadiene synthase from the fungus (PaFS) is an assembly-line terpene synthase that catalyzes the first two steps in the biosynthesis of Fusiccocin A, a diterpene glycoside. The C-terminal ...Fusicoccadiene synthase from the fungus (PaFS) is an assembly-line terpene synthase that catalyzes the first two steps in the biosynthesis of Fusiccocin A, a diterpene glycoside. The C-terminal prenyltransferase domain of PaFS catalyzes the condensation of one molecule of C dimethylallyl diphosphate and three molecules of C isopentenyl diphosphate to form C geranylgeranyl diphosphate, which then transits to the cyclase domain for cyclization to form fusicoccadiene. Previous structural studies of PaFS using electron microscopy (EM) revealed a central octameric prenyltransferase core with eight cyclase domains tethered in random distal positions through flexible 70-residue linkers. However, proximal prenyltransferase-cyclase configurations could be captured by covalent cross-linking and observed by cryo-EM and mass spectrometry. Here, we use cryo-EM to show that proximally configured prenyltransferase-cyclase complexes are observable even in the absence of covalent cross-linking; moreover, such complexes can involve multiple cyclase domains. A conserved basic patch on the prenyltransferase domain comprises the primary touchpoint with the cyclase domain. These results support a model for transient prenyltransferase-cyclase association in which the cyclase domains of PaFS are in facile equilibrium between proximal associated and random distal positions relative to the central prenyltransferase octamer. The results of biophysical measurements using small-angle X-ray scattering, analytical ultracentrifugation, dynamic light scattering, and size-exclusion chromatography in-line with multi-angle light scattering are consistent with this model. This model accordingly provides a framework for understanding substrate transit between the prenyltransferase and cyclase domains as well as the cooperativity observed for geranylgeranyl diphosphate cyclization. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_28220.map.gz emd_28220.map.gz | 20.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-28220-v30.xml emd-28220-v30.xml emd-28220.xml emd-28220.xml | 18.8 KB 18.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_28220_fsc.xml emd_28220_fsc.xml | 6.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_28220.png emd_28220.png | 50 KB | ||
| マスクデータ |  emd_28220_msk_1.map emd_28220_msk_1.map | 27 MB |  マスクマップ マスクマップ | |
| その他 |  emd_28220_half_map_1.map.gz emd_28220_half_map_1.map.gz emd_28220_half_map_2.map.gz emd_28220_half_map_2.map.gz | 20.7 MB 20.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-28220 http://ftp.pdbj.org/pub/emdb/structures/EMD-28220 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28220 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28220 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_28220_validation.pdf.gz emd_28220_validation.pdf.gz | 728.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_28220_full_validation.pdf.gz emd_28220_full_validation.pdf.gz | 727.9 KB | 表示 | |
| XML形式データ |  emd_28220_validation.xml.gz emd_28220_validation.xml.gz | 12.7 KB | 表示 | |
| CIF形式データ |  emd_28220_validation.cif.gz emd_28220_validation.cif.gz | 17.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28220 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28220 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28220 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28220 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_28220.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_28220.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | PaFS prenyltransferase core with single interacting cyclase domain - West class B | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.66 Å | ||||||||||||||||||||||||||||||||||||
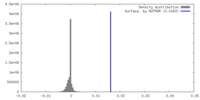
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_28220_msk_1.map emd_28220_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
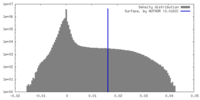
| 密度ヒストグラム |
-ハーフマップ: Half Map 1
| ファイル | emd_28220_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
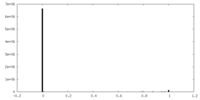
| 密度ヒストグラム |
-ハーフマップ: Half Map 2
| ファイル | emd_28220_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
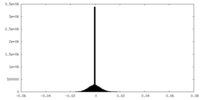
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Octamer of the prenylstransferase domain of fusicoccadiene syntha...
| 全体 | 名称: Octamer of the prenylstransferase domain of fusicoccadiene synthase from Phomopsis amygdali (PaFS) |
|---|---|
| 要素 |
|
-超分子 #1: Octamer of the prenylstransferase domain of fusicoccadiene syntha...
| 超分子 | 名称: Octamer of the prenylstransferase domain of fusicoccadiene synthase from Phomopsis amygdali (PaFS) タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Diaporthe amygdali (菌類) Diaporthe amygdali (菌類) |
| 組換発現 | 生物種:  |
| 分子量 | 実験値: 680 KDa |
-分子 #1: Fusicoccadiene synthase
| 分子 | 名称: Fusicoccadiene synthase / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO / EC番号: fusicocca-2,10(14)-diene synthase |
|---|---|
| 由来(天然) | 生物種:  Diaporthe amygdali (菌類) Diaporthe amygdali (菌類) |
| 配列 | 文字列: MGSSHHHHHH SSGLVPRGSH MEFKYSEVVE PSTYYTEGLC EGIDVRKSKF TTLEDRGAIR AHEDWNKHIG PCREYRGTLG PRFSFISVAV PECIPERLEV ISYANEFAFL HDDVTDHVGH DTGEVENDEM MTVFLEAAHT GAIDTSNKVD IRRAGKKRIQ SQLFLEMLAI ...文字列: MGSSHHHHHH SSGLVPRGSH MEFKYSEVVE PSTYYTEGLC EGIDVRKSKF TTLEDRGAIR AHEDWNKHIG PCREYRGTLG PRFSFISVAV PECIPERLEV ISYANEFAFL HDDVTDHVGH DTGEVENDEM MTVFLEAAHT GAIDTSNKVD IRRAGKKRIQ SQLFLEMLAI DPECAKTTMK SWARFVEVGS SRQHETRFVE LAKYIPYRIM DVGEMFWFGL VTFGLGLHIP DHELELCREL MANAWIAVGL QNDIWSWPKE RDAATLHGKD HVVNAIWVLM QEHQTDVDGA MQICRKLIVE YVAKYLEVIE ATKNDESISL DLRKYLDAML YSISGNVVWS LECPRYNPDV SFNKTQLEWM RQGLPSLESC PVLARSPEID SDESAVSPTA DESDSTEDSL GSGSRQDSSL STGLSLSPVH SNEGKDLQRV DTDHIFFEKA VLEAPYDYIA SMPSKGVRDQ FIDALNDWLR VPDVKVGKIK DAVRVLHNSS LLLDDFQDNS PLRRGKPSTH NIFGSAQTVN TATYSIIKAI GQIMEFSAGE SVQEVMNSIM ILFQGQAMDL FWTYNGHVPS EEEYYRMIDQ KTGQLFSIAT SLLLNAADNE IPRTKIQSCL HRLTRLLGRC FQICDDYQNL VSADYTKQKG FCEDLDEGKW SLALIHMIHK QRSHMALLNV LSTGRKHGGM TLEQKQFVLD IIEEEKSLDY TRSVMMDLHV QLRAEIGRIE ILLDSPNPAM RLLLELLRV |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 検出モード: SUPER-RESOLUTION / 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)