+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM reveals the molecular basis of laminin polymerization and LN-lamininopathies | |||||||||
 マップデータ マップデータ | Unsharpened map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Laminin / Complex / Basement membrane / STRUCTURAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報laminin-3 complex / laminin-11 complex / laminin-2 complex / neuronal-glial interaction involved in cerebral cortex radial glia guided migration / laminin-8 complex / laminin complex / laminin-1 complex / laminin-10 complex / retinal blood vessel morphogenesis / regulation of basement membrane organization ...laminin-3 complex / laminin-11 complex / laminin-2 complex / neuronal-glial interaction involved in cerebral cortex radial glia guided migration / laminin-8 complex / laminin complex / laminin-1 complex / laminin-10 complex / retinal blood vessel morphogenesis / regulation of basement membrane organization / L1CAM interactions / morphogenesis of an epithelial sheet / hemidesmosome assembly / glycosphingolipid binding / positive regulation of integrin-mediated signaling pathway / tissue development / Laminin interactions / EGR2 and SOX10-mediated initiation of Schwann cell myelination / endoderm development / branching involved in salivary gland morphogenesis / protein complex involved in cell-matrix adhesion / establishment of epithelial cell apical/basal polarity / camera-type eye development / blood vessel morphogenesis / odontogenesis / MET activates PTK2 signaling / extracellular matrix structural constituent / epithelial tube branching involved in lung morphogenesis / maintenance of blood-brain barrier / positive regulation of muscle cell differentiation / endodermal cell differentiation / regulation of embryonic development / positive regulation of cell adhesion / Non-integrin membrane-ECM interactions / basement membrane / ECM proteoglycans / extracellular matrix disassembly / regulation of cell migration / Degradation of the extracellular matrix / substrate adhesion-dependent cell spreading / extracellular matrix / positive regulation of epithelial cell proliferation / axon guidance / animal organ morphogenesis / Post-translational protein phosphorylation / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / neuron projection development / cell-cell junction / cell migration / retina development in camera-type eye / protein-containing complex assembly / collagen-containing extracellular matrix / cell surface receptor signaling pathway / cell adhesion / positive regulation of cell migration / endoplasmic reticulum lumen / protein phosphorylation / signaling receptor binding / structural molecule activity / perinuclear region of cytoplasm / extracellular space / extracellular exosome / extracellular region / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.7 Å | |||||||||
 データ登録者 データ登録者 | Kulczyk AW | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Cryo-EM reveals the molecular basis oflaminin polymerization and LN-lamininopathies. 著者: Arkadiusz W Kulczyk / Karen K McKee / Ximo Zhang / Iwona Bizukojc / Ying Q Yu / Peter D Yurchenco /  要旨: Laminin polymerization is the major step in basement membranes assembly. Its failures cause laminin N-terminal domain lamininopathies including Pierson syndrome. We have employed cryo-electron ...Laminin polymerization is the major step in basement membranes assembly. Its failures cause laminin N-terminal domain lamininopathies including Pierson syndrome. We have employed cryo-electron microscopy to determine a 3.7 Å structure of the trimeric laminin polymer node containing α1, β1 and γ1 subunits. The structure reveals the molecular basis of calcium-dependent formation of laminin lattice, and provides insights into polymerization defects manifesting in human disease. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27542.map.gz emd_27542.map.gz | 53.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27542-v30.xml emd-27542-v30.xml emd-27542.xml emd-27542.xml | 20 KB 20 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_27542_fsc.xml emd_27542_fsc.xml | 10.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_27542.png emd_27542.png | 26.6 KB | ||
| その他 |  emd_27542_additional_1.map.gz emd_27542_additional_1.map.gz emd_27542_half_map_1.map.gz emd_27542_half_map_1.map.gz emd_27542_half_map_2.map.gz emd_27542_half_map_2.map.gz | 50.5 MB 94.9 MB 95.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27542 http://ftp.pdbj.org/pub/emdb/structures/EMD-27542 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27542 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27542 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8dmkMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27542.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27542.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened map | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.972 Å | ||||||||||||||||||||
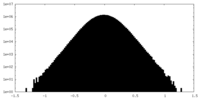
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Sharpened map
| ファイル | emd_27542_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
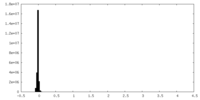
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_27542_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
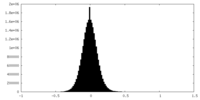
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_27542_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
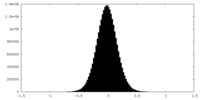
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Lamimin polymer node
| 全体 | 名称: Lamimin polymer node |
|---|---|
| 要素 |
|
-超分子 #1: Lamimin polymer node
| 超分子 | 名称: Lamimin polymer node / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 詳細: A trimeric complex of the N-terminal fragments (LN, LE1, LE2 domains) from laminin alpha 1, laminin beta 1 and laminin gamma 1. |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 172 KDa |
-分子 #1: Laminin subunit alpha-1
| 分子 | 名称: Laminin subunit alpha-1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 34.709211 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GLFPAILNLA TNAHISANAT CGEKGPEMFC KLVEHVPGRP VRHAQCRVCD GNSTNPRERH PISHAIDGTN NWWQSPSIQN GREYHWVTV TLDLRQVFQV AYIIIKAANA PRPGNWILER SVDGVKFKPW QYYAVSDTEC LTRYKITPRR GPPTYRADNE V ICTSYYSK ...文字列: GLFPAILNLA TNAHISANAT CGEKGPEMFC KLVEHVPGRP VRHAQCRVCD GNSTNPRERH PISHAIDGTN NWWQSPSIQN GREYHWVTV TLDLRQVFQV AYIIIKAANA PRPGNWILER SVDGVKFKPW QYYAVSDTEC LTRYKITPRR GPPTYRADNE V ICTSYYSK LVPLEHGEIH TSLINGRPSA DDPSPQLLEF TSARYIRLRL QRIRTLNADL MTLSHRDLRD LDPIVTRRYY YS IKDISVG GMCICYGHAS SCPWDEEAKQ LQCQCEHNTC GESCDRCCPG YHQQPWRPGT ISSGNECE UniProtKB: Laminin subunit alpha-1 |
-分子 #2: Laminin subunit beta-1
| 分子 | 名称: Laminin subunit beta-1 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 35.09191 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GCAEGSCYPA TGDLLIGRAQ KLSVTSTCGL HKPEPYCIVS HLQEDKKCFI CNSQDPYHET LNPDSHLIEN VVTTFAPNRL KIWWQSENG VENVTIQLDL EAEFHFTHLI MTFKTFRPAA MLIERSSDFG KTWGVYRYFA YDCEASFPGI STGPMKKVDD I ICDSRYSD ...文字列: GCAEGSCYPA TGDLLIGRAQ KLSVTSTCGL HKPEPYCIVS HLQEDKKCFI CNSQDPYHET LNPDSHLIEN VVTTFAPNRL KIWWQSENG VENVTIQLDL EAEFHFTHLI MTFKTFRPAA MLIERSSDFG KTWGVYRYFA YDCEASFPGI STGPMKKVDD I ICDSRYSD IEPSTEGEVI FRALDPAFKI EDPYSPRIQN LLKITNLRIK FVKLHTLGDN LLDSRMEIRE KYYYAVYDMV VR GNCFCYG HASECAPVDG FNEEVEGMVH GHCMCRHNTK GLNCELCMDF YHDLPWRPAE GRNSNACKKC UniProtKB: Laminin subunit beta-1 |
-分子 #3: Laminin subunit gamma-1
| 分子 | 名称: Laminin subunit gamma-1 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 34.110816 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MDECTDEGGR PQRCMPEFVN AAFNVTVVAT NTCGTPPEEY CVQTGVTGVT KSCHLCDAGQ PHLQHGAAFL TDYNNQADTT WWQSQTMLA GVQYPSSINL TLHLGKAFDI TYVRLKFHTS RPESFAIYKR TWEDGPWIPY QYYSGSCENT YSKANRGFIR T GGDEQQAL ...文字列: MDECTDEGGR PQRCMPEFVN AAFNVTVVAT NTCGTPPEEY CVQTGVTGVT KSCHLCDAGQ PHLQHGAAFL TDYNNQADTT WWQSQTMLA GVQYPSSINL TLHLGKAFDI TYVRLKFHTS RPESFAIYKR TWEDGPWIPY QYYSGSCENT YSKANRGFIR T GGDEQQAL CTDEFSDISP LTGGNVAFST LEGRPSAYNF DNSPVLQEWV TATDISVTLN RLNTFGDEVF NDPKVLKSYY YA ISDFAVG GRCKCNGHAS ECMKNEFDKL VCNCKHNTYG VDCEKCLPFF NDRPWRRATA ESASECLP UniProtKB: Laminin subunit gamma-1 |
-分子 #4: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 4 / コピー数: 5 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-分子 #5: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 5 / コピー数: 1 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: Quantifoil / 材質: GOLD / メッシュ: 300 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 1.8 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 130000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-8dmk: |
 ムービー
ムービー コントローラー
コントローラー


















 Z
Z Y
Y X
X