+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human glycogenin-1 and glycogen synthase-1 complex in the apo mobile state | |||||||||
 マップデータ マップデータ | Sharpened map of GYS1:GYG1 apo mobile complex | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Metabolism Glycogen synthesis Glycogen synthase Glycogenin / TRANSFERASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報glycogen synthase activity, transferring glucose-1-phosphate / Glycogen storage disease type XV (GYG1) / Glycogen storage disease type 0 (muscle GYS1) / glycogen(starch) synthase / Glycogen storage disease type II (GAA) / glycogenin glucosyltransferase / glycogenin glucosyltransferase activity / : / glycogen (starch) synthase activity / D-glucose binding ...glycogen synthase activity, transferring glucose-1-phosphate / Glycogen storage disease type XV (GYG1) / Glycogen storage disease type 0 (muscle GYS1) / glycogen(starch) synthase / Glycogen storage disease type II (GAA) / glycogenin glucosyltransferase / glycogenin glucosyltransferase activity / : / glycogen (starch) synthase activity / D-glucose binding / glycogen biosynthetic process / Glycogen breakdown (glycogenolysis) / glycosyltransferase activity / inclusion body / Myoclonic epilepsy of Lafora / Glycogen synthesis / lysosomal lumen / heart development / manganese ion binding / secretory granule lumen / ficolin-1-rich granule lumen / Neutrophil degranulation / protein homodimerization activity / extracellular region / membrane / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | |||||||||
 データ登録者 データ登録者 | Liu Y / Fastman NM / Tzitzilonis C | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Cell Rep / 年: 2022 ジャーナル: Cell Rep / 年: 2022タイトル: The structural mechanism of human glycogen synthesis by the GYS1-GYG1 complex. 著者: Nathan M Fastman / Yuxi Liu / Vyas Ramanan / Hanne Merritt / Eileen Ambing / Anna A DePaoli-Roach / Peter J Roach / Thomas D Hurley / Kevin T Mellem / Julie C Ullman / Eric Green / David ...著者: Nathan M Fastman / Yuxi Liu / Vyas Ramanan / Hanne Merritt / Eileen Ambing / Anna A DePaoli-Roach / Peter J Roach / Thomas D Hurley / Kevin T Mellem / Julie C Ullman / Eric Green / David Morgans / Christos Tzitzilonis /  要旨: Glycogen is the primary energy reserve in mammals, and dysregulation of glycogen metabolism can result in glycogen storage diseases (GSDs). In muscle, glycogen synthesis is initiated by the enzymes ...Glycogen is the primary energy reserve in mammals, and dysregulation of glycogen metabolism can result in glycogen storage diseases (GSDs). In muscle, glycogen synthesis is initiated by the enzymes glycogenin-1 (GYG1), which seeds the molecule by autoglucosylation, and glycogen synthase-1 (GYS1), which extends the glycogen chain. Although both enzymes are required for proper glycogen production, the nature of their interaction has been enigmatic. Here, we present the human GYS1:GYG1 complex in multiple conformations representing different functional states. We observe an asymmetric conformation of GYS1 that exposes an interface for close GYG1 association, and propose this state facilitates handoff of the GYG1-associated glycogen chain to a GYS1 subunit for elongation. Full activation of GYS1 widens the GYG1-binding groove, enabling GYG1 release concomitant with glycogen chain growth. This structural mechanism connecting chain nucleation and extension explains the apparent stepwise nature of glycogen synthesis and suggests distinct states to target for GSD-modifying therapeutics. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27021.map.gz emd_27021.map.gz | 122.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27021-v30.xml emd-27021-v30.xml emd-27021.xml emd-27021.xml | 21.4 KB 21.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
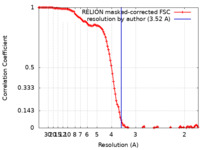
| FSC (解像度算出) |  emd_27021_fsc.xml emd_27021_fsc.xml | 11.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_27021.png emd_27021.png | 168.9 KB | ||
| マスクデータ |  emd_27021_msk_1.map emd_27021_msk_1.map | 129.7 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-27021.cif.gz emd-27021.cif.gz | 6.5 KB | ||
| その他 |  emd_27021_additional_1.map.gz emd_27021_additional_1.map.gz emd_27021_half_map_1.map.gz emd_27021_half_map_1.map.gz emd_27021_half_map_2.map.gz emd_27021_half_map_2.map.gz | 64.6 MB 120.4 MB 120.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27021 http://ftp.pdbj.org/pub/emdb/structures/EMD-27021 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27021 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27021 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27021_validation.pdf.gz emd_27021_validation.pdf.gz | 974.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27021_full_validation.pdf.gz emd_27021_full_validation.pdf.gz | 974.4 KB | 表示 | |
| XML形式データ |  emd_27021_validation.xml.gz emd_27021_validation.xml.gz | 19.1 KB | 表示 | |
| CIF形式データ |  emd_27021_validation.cif.gz emd_27021_validation.cif.gz | 24.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27021 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27021 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27021 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27021 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27021.map.gz / 形式: CCP4 / 大きさ: 129.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27021.map.gz / 形式: CCP4 / 大きさ: 129.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map of GYS1:GYG1 apo mobile complex | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.9142 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_27021_msk_1.map emd_27021_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
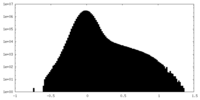
| 投影像・断面図 |
| ||||||||||||
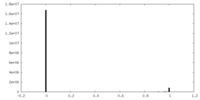
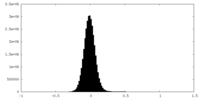
| 密度ヒストグラム |
-追加マップ: Unsharpened map of GYS1:GYG1 apo mobile complex
| ファイル | emd_27021_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened map of GYS1:GYG1 apo mobile complex | ||||||||||||
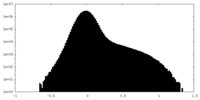
| 投影像・断面図 |
| ||||||||||||
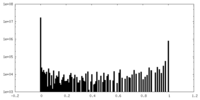
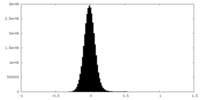
| 密度ヒストグラム |
-ハーフマップ: Half map A of GYS1:GYG1 apo mobile complex
| ファイル | emd_27021_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A of GYS1:GYG1 apo mobile complex | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
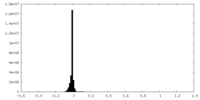
| 密度ヒストグラム |
-ハーフマップ: Half map B of GYS1:GYG1 apo mobile complex
| ファイル | emd_27021_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map B of GYS1:GYG1 apo mobile complex | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
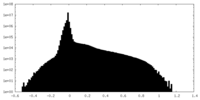
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human glycogenin-1 and glycogen synthase-1 complex in the apo ord...
| 全体 | 名称: Human glycogenin-1 and glycogen synthase-1 complex in the apo ordered state |
|---|---|
| 要素 |
|
-超分子 #1: Human glycogenin-1 and glycogen synthase-1 complex in the apo ord...
| 超分子 | 名称: Human glycogenin-1 and glycogen synthase-1 complex in the apo ordered state タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 450 KDa |
-分子 #1: Glycogen [starch] synthase, muscle
| 分子 | 名称: Glycogen [starch] synthase, muscle / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号: glycogen(starch) synthase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 72.634438 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPLNRTLEMS ELPGLEDWED EFDLENAVLF EVAWEVANKV GGIYTVLQTK AKVTGDEWGD NYFLVGPYTE QGVRTQVELL EAPTPALKR TLDSMNSKGC KVYFGRWLIE GGPLVVLLDV GASAWALERW KGELWDTCNI GVPWYDREAN DAVLFGFLTT W FLGEFLAQ ...文字列: MPLNRTLEMS ELPGLEDWED EFDLENAVLF EVAWEVANKV GGIYTVLQTK AKVTGDEWGD NYFLVGPYTE QGVRTQVELL EAPTPALKR TLDSMNSKGC KVYFGRWLIE GGPLVVLLDV GASAWALERW KGELWDTCNI GVPWYDREAN DAVLFGFLTT W FLGEFLAQ SEEKPHVVAH FHEWLAGVGL CLCRARRLPV ATIFTTHATL LGRYLCAGAV DFYNNLENFN VDKEAGERQI YH RYCMERA AAHCAHVFTT VSQITAIEAQ HLLKRKPDIV TPNGLNVKKF SAMHEFQNLH AQSKARIQEF VRGHFYGHLD FNL DKTLYF FIAGRYEFSN KGADVFLEAL ARLNYLLRVN GSEQTVVAFF IMPARTNNFN VETLKGQAVR KQLWDTANTV KEKF GRKLY ESLLVGSLPD MNKMLDKEDF TMMKRAIFAT QRQSFPPVCT HNMLDDSSDP ILTTIRRIGL FNSSADRVKV IFHPE FLSS TSPLLPVDYE EFVRGCHLGV FPSYYEPWGY TPAECTVMGI PSISTNLSGF GCFMEEHIAD PSAYGIYILD RRFRSL DDS CSQLTSFLYS FCQQSRRQRI IQRNRTERLS DLLDWKYLGR YYMSARHMAL SKAFPEHFTY EPNEADAAQG Y UniProtKB: Glycogen [starch] synthase, muscle |
-分子 #2: Glycogenin-1
| 分子 | 名称: Glycogenin-1 / タイプ: protein_or_peptide / ID: 2 / コピー数: 3 / 光学異性体: LEVO / EC番号: glycogenin glucosyltransferase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 39.560789 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GPMTDQAFVT LTTNDAYAKG ALVLGSSLKQ HRTTRRLVVL ATPQVSDSMR KVLETVFDEV IMVDVLDSGD SAHLTLMKRP ELGVTLTKL HCWSLTQYSK CVFMDADTLV LANIDDLFDR EELSAAPDPG WPDCFNSGVF VYQPSVETYN QLLHLASEQG S FDGGDQGI ...文字列: GPMTDQAFVT LTTNDAYAKG ALVLGSSLKQ HRTTRRLVVL ATPQVSDSMR KVLETVFDEV IMVDVLDSGD SAHLTLMKRP ELGVTLTKL HCWSLTQYSK CVFMDADTLV LANIDDLFDR EELSAAPDPG WPDCFNSGVF VYQPSVETYN QLLHLASEQG S FDGGDQGI LNTFFSSWAT TDIRKHLPFI YNLSSISIFS YLPAFKVFGA SAKVVHFLGR VKPWNYTYDP KTKSVKSEAH DP NMTHPEF LILWWNIFTT NVLPLLQQFG LVKDTCSYVN VLSDLVYTLA FSCGFCRKED VSGAISHLSL GEIPAMAQPF VSS EERKER WEQGQADYMG ADSFDNIKRK LDTYLQ UniProtKB: Glycogenin-1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.9 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 200 | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV / 詳細: 7 sec blotting time, 15 blot force. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 実像数: 8536 / 平均電子線量: 45.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.4 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: RECIPROCAL / プロトコル: FLEXIBLE FIT |
|---|---|
| 得られたモデル |  PDB-8cvy: |
 ムービー
ムービー コントローラー
コントローラー















 Z
Z Y
Y X
X