+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of RIG-I in complex with OHdsRNA | |||||||||
 マップデータ マップデータ | Cryo-EM structure of protein-RNA complex 4 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ribonucleoprotein complex / RNA sensor / RIG-I like receptor / IMMUNE SYSTEM / IMMUNE SYSTEM-RNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of type III interferon production / RIG-I signaling pathway / positive regulation of myeloid dendritic cell cytokine production / OAS antiviral response / detection of virus / NF-kB activation through FADD/RIP-1 pathway mediated by caspase-8 and -10 / positive regulation of response to cytokine stimulus / cytoplasmic pattern recognition receptor signaling pathway / positive regulation of granulocyte macrophage colony-stimulating factor production / cellular response to exogenous dsRNA ...regulation of type III interferon production / RIG-I signaling pathway / positive regulation of myeloid dendritic cell cytokine production / OAS antiviral response / detection of virus / NF-kB activation through FADD/RIP-1 pathway mediated by caspase-8 and -10 / positive regulation of response to cytokine stimulus / cytoplasmic pattern recognition receptor signaling pathway / positive regulation of granulocyte macrophage colony-stimulating factor production / cellular response to exogenous dsRNA / pattern recognition receptor activity / TRAF6 mediated IRF7 activation / RSV-host interactions / response to exogenous dsRNA / positive regulation of interferon-alpha production / TRAF6 mediated NF-kB activation / bicellular tight junction / positive regulation of defense response to virus by host / antiviral innate immune response / positive regulation of interferon-beta production / regulation of cell migration / positive regulation of interleukin-8 production / Negative regulators of DDX58/IFIH1 signaling / DDX58/IFIH1-mediated induction of interferon-alpha/beta / response to virus / Evasion by RSV of host interferon responses / ISG15 antiviral mechanism / ruffle membrane / positive regulation of interleukin-6 production / SARS-CoV-1 activates/modulates innate immune responses / positive regulation of tumor necrosis factor production / double-stranded RNA binding / Ovarian tumor domain proteases / actin cytoskeleton / TRAF3-dependent IRF activation pathway / gene expression / double-stranded DNA binding / defense response to virus / RNA helicase activity / single-stranded RNA binding / Ub-specific processing proteases / RNA helicase / ribonucleoprotein complex / innate immune response / ubiquitin protein ligase binding / positive regulation of gene expression / GTP binding / SARS-CoV-2 activates/modulates innate and adaptive immune responses / positive regulation of transcription by RNA polymerase II / ATP hydrolysis activity / zinc ion binding / ATP binding / identical protein binding / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
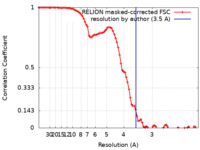
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.5 Å | |||||||||
 データ登録者 データ登録者 | Wang W / Pyle AM | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2022 ジャーナル: Mol Cell / 年: 2022タイトル: The RIG-I receptor adopts two different conformations for distinguishing host from viral RNA ligands. 著者: Wenshuai Wang / Anna Marie Pyle /  要旨: RIG-I is an essential innate immune receptor for detecting and responding to infection by RNA viruses. RIG-I specifically recognizes the unique molecular features of viral RNA molecules and ...RIG-I is an essential innate immune receptor for detecting and responding to infection by RNA viruses. RIG-I specifically recognizes the unique molecular features of viral RNA molecules and selectively distinguishes them from closely related RNAs abundant in host cells. The physical basis for this exquisite selectivity is revealed through a series of high-resolution cryo-EM structures of RIG-I in complex with host and viral RNA ligands. These studies demonstrate that RIG-I actively samples double-stranded RNAs in the cytoplasm and distinguishes them by adopting two different types of protein folds. Upon binding viral RNA, RIG-I adopts a high-affinity conformation that is conducive to signaling, while host RNA induces an autoinhibited conformation that stimulates RNA release. By coupling protein folding with RNA binding selectivity, RIG-I distinguishes RNA molecules that differ by as little as one phosphate group, thereby explaining the molecular basis for selective antiviral sensing and the induction of autoimmunity upon RIG-I dysregulation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_26025.map.gz emd_26025.map.gz | 49.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-26025-v30.xml emd-26025-v30.xml emd-26025.xml emd-26025.xml | 11.6 KB 11.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_26025_fsc.xml emd_26025_fsc.xml | 8.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_26025.png emd_26025.png | 57.8 KB | ||
| Filedesc metadata |  emd-26025.cif.gz emd-26025.cif.gz | 6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-26025 http://ftp.pdbj.org/pub/emdb/structures/EMD-26025 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26025 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26025 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_26025_validation.pdf.gz emd_26025_validation.pdf.gz | 543.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_26025_full_validation.pdf.gz emd_26025_full_validation.pdf.gz | 543 KB | 表示 | |
| XML形式データ |  emd_26025_validation.xml.gz emd_26025_validation.xml.gz | 10.5 KB | 表示 | |
| CIF形式データ |  emd_26025_validation.cif.gz emd_26025_validation.cif.gz | 13.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26025 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26025 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26025 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26025 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7to0MC  7tnxC  7tnyC  7tnzC  7to1C  7to2C  8dvrC  8dvsC  8dvuC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_26025.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_26025.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM structure of protein-RNA complex 4 | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.068 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Complex of RIG-I with OHdsRNA
| 全体 | 名称: Complex of RIG-I with OHdsRNA |
|---|---|
| 要素 |
|
-超分子 #1: Complex of RIG-I with OHdsRNA
| 超分子 | 名称: Complex of RIG-I with OHdsRNA / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Antiviral innate immune response receptor RIG-I
| 分子 | 名称: Antiviral innate immune response receptor RIG-I / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: RNA helicase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 106.740555 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTTEQRRSLQ AFQDYIRKTL DPTYILSYMA PWFREEEVQY IQAEKNNKGP MEAATLFLKF LLELQEEGWF RGFLDALDHA GYSGLYEAI ESWDFKKIEK LEEYRLLLKR LQPEFKTRII PTDIISDLSE CLINQECEEI LQICSTKGMM AGAEKLVECL L RSDKENWP ...文字列: MTTEQRRSLQ AFQDYIRKTL DPTYILSYMA PWFREEEVQY IQAEKNNKGP MEAATLFLKF LLELQEEGWF RGFLDALDHA GYSGLYEAI ESWDFKKIEK LEEYRLLLKR LQPEFKTRII PTDIISDLSE CLINQECEEI LQICSTKGMM AGAEKLVECL L RSDKENWP KTLKLALEKE RNKFSELWIV EKGIKDVETE DLEDKMETSD IQIFYQEDPE CQNLSENSCP PSEVSDTNLY SP FKPRNYQ LELALPAMKG KNTIICAPTG CGKTFVSLLI CEHHLKKFPQ GQKGKVVFFA NQIPVYEQQK SVFSKYFERH GYR VTGISG ATAENVPVEQ IVENNDIIIL TPQILVNNLK KGTIPSLSIF TLMIFDECHN TSKQHPYNMI MFNYLDQKLG GSSG PLPQV IGLTASVGVG DAKNTDEALD YICKLCASLD ASVIATVKHN LEELEQVVYK PQKFFRKVES RISDKFKYII AQLMR DTES LAKRICKDLE NLSQIQNREF GTQKYEQWIV TVQKACMVFQ MPDKDEESRI CKALFLYTSH LRKYNDALII SEHARM KDA LDYLKDFFSN VRAAGFDEIE QDLTQRFEEK LQELESVSRD PSNENPKLED LCFILQEEYH LNPETITILF VKTRALV DA LKNWIEGNPK LSFLKPGILT GRGKTNQNTG MTLPAQKCIL DAFKASGDHN ILIATSVADE GIDIAQCNLV ILYEYVGN V IKMIQTRGRG RARGSKCFLL TSNAGVIEKE QINMYKEKMM NDSILRLQTW DEAVFREKIL HIQTHEKFIR DSQEKPKPV PDKENKKLLC RKCKALACYT ADVRVIEECH YTVLGDAFKE CFVSRPHPKP KQFSSFEKRA KIFCARQNCS HDWGIHVKYK TFEIPVIKI ESFVVEDIAT GVQTLYSKWK DFHFEKIPFD PAEMSK UniProtKB: Antiviral innate immune response receptor RIG-I |
-分子 #2: OHdsRNA
| 分子 | 名称: OHdsRNA / タイプ: rna / ID: 2 / コピー数: 2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 7.69963 KDa |
| 配列 | 文字列: GGACGUACGU CGCGACGUAC GUCC |
-分子 #3: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 3 / コピー数: 1 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 59.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.2 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)