+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-21893 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of VASH1-SVBP bound to microtubules | |||||||||
 マップデータ マップデータ | Cryo-EM structure of VASH1-SVBP bound to microtubules | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Microtubule / Posttranslational modification / Detyrosination / Vasohibin / PROTEIN BINDING | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of metallopeptidase activity / tubulinyl-Tyr carboxypeptidase / tubulin-tyrosine carboxypeptidase / netrin receptor binding / Post-chaperonin tubulin folding pathway / axonemal microtubule / dorsal root ganglion development / Microtubule-dependent trafficking of connexons from Golgi to the plasma membrane / Cilium Assembly / regulation of cellular senescence ...regulation of metallopeptidase activity / tubulinyl-Tyr carboxypeptidase / tubulin-tyrosine carboxypeptidase / netrin receptor binding / Post-chaperonin tubulin folding pathway / axonemal microtubule / dorsal root ganglion development / Microtubule-dependent trafficking of connexons from Golgi to the plasma membrane / Cilium Assembly / regulation of cellular senescence / Carboxyterminal post-translational modifications of tubulin / negative regulation of lymphangiogenesis / organelle transport along microtubule / glial cell differentiation / peptidase activator activity / forebrain morphogenesis / Sealing of the nuclear envelope (NE) by ESCRT-III / Intraflagellar transport / neuron projection arborization / cytoskeleton-dependent intracellular transport / cerebellar cortex morphogenesis / Formation of tubulin folding intermediates by CCT/TriC / dentate gyrus development / COPI-independent Golgi-to-ER retrograde traffic / pyramidal neuron differentiation / Gap junction assembly / Prefoldin mediated transfer of substrate to CCT/TriC / Kinesins / Assembly and cell surface presentation of NMDA receptors / metallocarboxypeptidase activity / centrosome cycle / motor behavior / negative regulation of endothelial cell migration / COPI-dependent Golgi-to-ER retrograde traffic / labyrinthine layer blood vessel development / response to L-glutamate / smoothened signaling pathway / intercellular bridge / regulation of synapse organization / axon development / startle response / negative regulation of endothelial cell proliferation / locomotory exploration behavior / Recycling pathway of L1 / microtubule polymerization / microtubule-based process / negative regulation of blood vessel endothelial cell migration / protein secretion / RHO GTPases activate IQGAPs / response to tumor necrosis factor / Hedgehog 'off' state / regulation of angiogenesis / COPI-mediated anterograde transport / response to mechanical stimulus / Activation of AMPK downstream of NMDARs / condensed chromosome / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / homeostasis of number of cells within a tissue / Recruitment of NuMA to mitotic centrosomes / negative regulation of protein ubiquitination / Anchoring of the basal body to the plasma membrane / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / MHC class II antigen presentation / Resolution of Sister Chromatid Cohesion / AURKA Activation by TPX2 / cellular response to calcium ion / negative regulation of angiogenesis / adult locomotory behavior / filopodium / axon guidance / cell periphery / Translocation of SLC2A4 (GLUT4) to the plasma membrane / RHO GTPases Activate Formins / intracellular protein transport / neuron migration / peptide binding / synapse organization / neuromuscular junction / visual learning / PKR-mediated signaling / recycling endosome / cerebral cortex development / structural constituent of cytoskeleton / mitotic spindle / memory / response to wounding / microtubule cytoskeleton organization / Aggrephagy / HCMV Early Events / cytoplasmic ribonucleoprotein granule / Separation of Sister Chromatids / The role of GTSE1 in G2/M progression after G2 checkpoint / microtubule cytoskeleton / Regulation of PLK1 Activity at G2/M Transition / apical part of cell / lamellipodium 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Li F / Li Y | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2020 ジャーナル: Elife / 年: 2020タイトル: Cryo-EM structure of VASH1-SVBP bound to microtubules. 著者: Faxiang Li / Yang Li / Xuecheng Ye / Haishan Gao / Zhubing Shi / Xuelian Luo / Luke M Rice / Hongtao Yu /   要旨: The dynamic tyrosination-detyrosination cycle of α-tubulin regulates microtubule functions. Perturbation of this cycle impairs mitosis, neural physiology, and cardiomyocyte contraction. The ...The dynamic tyrosination-detyrosination cycle of α-tubulin regulates microtubule functions. Perturbation of this cycle impairs mitosis, neural physiology, and cardiomyocyte contraction. The carboxypeptidases vasohibins 1 and 2 (VASH1 and VASH2), in complex with the small vasohibin-binding protein (SVBP), mediate α-tubulin detyrosination. These enzymes detyrosinate microtubules more efficiently than soluble αβ-tubulin heterodimers. The structural basis for this substrate preference is not understood. Using cryo-electron microscopy (cryo-EM), we have determined the structure of human VASH1-SVBP bound to microtubules. The acidic C-terminal tail of α-tubulin binds to a positively charged groove near the active site of VASH1. VASH1 forms multiple additional contacts with the globular domain of α-tubulin, including contacts with a second α-tubulin in an adjacent protofilament. Simultaneous engagement of two protofilaments by VASH1 can only occur within the microtubule lattice, but not with free αβ heterodimers. These lattice-specific interactions enable preferential detyrosination of microtubules by VASH1. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_21893.map.gz emd_21893.map.gz | 95.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-21893-v30.xml emd-21893-v30.xml emd-21893.xml emd-21893.xml | 14.1 KB 14.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_21893.png emd_21893.png | 118 KB | ||
| Filedesc metadata |  emd-21893.cif.gz emd-21893.cif.gz | 6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-21893 http://ftp.pdbj.org/pub/emdb/structures/EMD-21893 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21893 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21893 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_21893_validation.pdf.gz emd_21893_validation.pdf.gz | 529.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_21893_full_validation.pdf.gz emd_21893_full_validation.pdf.gz | 529.5 KB | 表示 | |
| XML形式データ |  emd_21893_validation.xml.gz emd_21893_validation.xml.gz | 4.4 KB | 表示 | |
| CIF形式データ |  emd_21893_validation.cif.gz emd_21893_validation.cif.gz | 4.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21893 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21893 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21893 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21893 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_21893.map.gz / 形式: CCP4 / 大きさ: 101.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_21893.map.gz / 形式: CCP4 / 大きさ: 101.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM structure of VASH1-SVBP bound to microtubules | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.83 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Tenary complex of microtubule with VASH1-SVBP complex
| 全体 | 名称: Tenary complex of microtubule with VASH1-SVBP complex |
|---|---|
| 要素 |
|
-超分子 #1: Tenary complex of microtubule with VASH1-SVBP complex
| 超分子 | 名称: Tenary complex of microtubule with VASH1-SVBP complex タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Tubulin alpha-1A chain
| 分子 | 名称: Tubulin alpha-1A chain / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 50.188441 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MRECISIHVG QAGVQIGNAC WELYCLEHGI QPDGQMPSDK TIGGGDDSFN TFFSETGAGK HVPRAVFVDL EPTVIDEVRT GTYRQLFHP EQLITGKEDA ANNYARGHYT IGKEIIDLVL DRIRKLADQC TGLQGFLVFH SFGGGTGSGF TSLLMERLSV D YGKKSKLE ...文字列: MRECISIHVG QAGVQIGNAC WELYCLEHGI QPDGQMPSDK TIGGGDDSFN TFFSETGAGK HVPRAVFVDL EPTVIDEVRT GTYRQLFHP EQLITGKEDA ANNYARGHYT IGKEIIDLVL DRIRKLADQC TGLQGFLVFH SFGGGTGSGF TSLLMERLSV D YGKKSKLE FSIYPAPQVS TAVVEPYNSI LTTHTTLEHS DCAFMVDNEA IYDICRRNLD IERPTYTNLN RLIGQIVSSI TA SLRFDGA LNVDLTEFQT NLVPYPRIHF PLATYAPVIS AEKAYHEQLS VAEITNACFE PANQMVKCDP RHGKYMACCL LYR GDVVPK DVNAAIATIK TKRTIQFVDW CPTGFKVGIN YQPPTVVPGG DLAKVQRAVC MLSNTTAIAE AWARLDHKFD LMYA KRAFV HWYVGEGMEE GEFSEAREDM AALEKDYEEV GVDSVEGEGE EEGEEY UniProtKB: Tubulin alpha-1A chain |
-分子 #2: Tubulin beta-3 chain
| 分子 | 名称: Tubulin beta-3 chain / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 50.48152 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MREIVHIQAG QCGNQIGAKF WEVISDEHGI DPSGNYVGDS DLQLERISVY YNEASSHKYV PRAILVDLEP GTMDSVRSGA FGHLFRPDN FIFGQSGAGN NWAKGHYTEG AELVDSVLDV VRKECENCDC LQGFQLTHSL GGGTGSGMGT LLISKVREEY P DRIMNTFS ...文字列: MREIVHIQAG QCGNQIGAKF WEVISDEHGI DPSGNYVGDS DLQLERISVY YNEASSHKYV PRAILVDLEP GTMDSVRSGA FGHLFRPDN FIFGQSGAGN NWAKGHYTEG AELVDSVLDV VRKECENCDC LQGFQLTHSL GGGTGSGMGT LLISKVREEY P DRIMNTFS VVPSPKVSDT VVEPYNATLS IHQLVENTDE TYCIDNEALY DICFRTLKLA TPTYGDLNHL VSATMSGVTT SL RFPGQLN ADLRKLAVNM VPFPRLHFFM PGFAPLTARG SQQYRALTVP ELTQQMFDAK NMMAACDPRH GRYLTVATVF RGR MSMKEV DEQMLAIQSK NSSYFVEWIP NNVKVAVCDI PPRGLKMSST FIGNSTAIQE LFKRISEQFT AMFRRKAFLH WYTG EGMDE MEFTEAESNM NDLVSEYQQY QDATAEEEGE MYEDDEEESE AQGPK UniProtKB: Tubulin beta-3 chain |
-分子 #3: Tubulinyl-Tyr carboxypeptidase 1
| 分子 | 名称: Tubulinyl-Tyr carboxypeptidase 1 / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO / EC番号: tubulinyl-Tyr carboxypeptidase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 29.780445 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: DLRDGGVPFF VNRGGLPVDE ATWERMWKHV AKIHPDGEKV AQRIRGATDL PKIPIPSVPT FQPSTPVPER LEAVQRYIRE LQYNHTGTQ FFEIKKSRPL TGLMDLAKEM TKEALPIKCL EAVILGIYLT NSMPTLERFP ISFKTYFSGN YFRHIVLGVN F AGRYGALG ...文字列: DLRDGGVPFF VNRGGLPVDE ATWERMWKHV AKIHPDGEKV AQRIRGATDL PKIPIPSVPT FQPSTPVPER LEAVQRYIRE LQYNHTGTQ FFEIKKSRPL TGLMDLAKEM TKEALPIKCL EAVILGIYLT NSMPTLERFP ISFKTYFSGN YFRHIVLGVN F AGRYGALG MSRREDLMYK PPAFRTLSEL VLDFEAAYGR CWHVLKKVKL GQSVSHDPHS VEQIEWKHSV LDVERLGRDD FR KELERHA RDMRLKIGKG TG UniProtKB: Tubulinyl-Tyr carboxypeptidase 1 |
-分子 #4: Small vasohibin-binding protein
| 分子 | 名称: Small vasohibin-binding protein / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 7.821939 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDPPARKEKT KVKESVSRVE KAKQKSAQQE LKQRQRAEIY ALNRVMTELE QQQFDEFCKQ MQPPGE UniProtKB: Small vasohibin-binding protein |
-分子 #5: GUANOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: GUANOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 2 / 式: GTP |
|---|---|
| 分子量 | 理論値: 523.18 Da |
| Chemical component information |  ChemComp-GTP: |
-分子 #6: PHOSPHOMETHYLPHOSPHONIC ACID GUANYLATE ESTER
| 分子 | 名称: PHOSPHOMETHYLPHOSPHONIC ACID GUANYLATE ESTER / タイプ: ligand / ID: 6 / コピー数: 2 / 式: G2P |
|---|---|
| 分子量 | 理論値: 521.208 Da |
| Chemical component information | 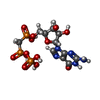 ChemComp-G2P: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 86 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: EMDB MAP |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 46999 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
 ムービー
ムービー コントローラー
コントローラー





































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















