+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | ATTRV20I amyloid fibril from hereditary ATTR amloidosis | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Transthyretin / ATTR amyloidosis / ATTRV20I / amyloid fibril / misfolding disease / cryo-EM / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Retinoid cycle disease events / The canonical retinoid cycle in rods (twilight vision) / thyroid hormone binding / purine nucleobase metabolic process / Non-integrin membrane-ECM interactions / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation ...Retinoid cycle disease events / The canonical retinoid cycle in rods (twilight vision) / thyroid hormone binding / purine nucleobase metabolic process / Non-integrin membrane-ECM interactions / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation / extracellular space / extracellular exosome / extracellular region / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
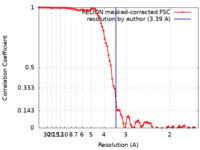
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.39 Å | |||||||||
 データ登録者 データ登録者 | Steinebrei M / Schmidt M / Faendrich M | |||||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Common transthyretin-derived amyloid fibril structures in patients with hereditary ATTR amyloidosis. 著者: Maximilian Steinebrei / Julian Baur / Anaviggha Pradhan / Niklas Kupfer / Sebastian Wiese / Ute Hegenbart / Stefan O Schönland / Matthias Schmidt / Marcus Fändrich /  要旨: Systemic ATTR amyloidosis is an increasingly important protein misfolding disease that is provoked by the formation of amyloid fibrils from transthyretin protein. The pathological and clinical ...Systemic ATTR amyloidosis is an increasingly important protein misfolding disease that is provoked by the formation of amyloid fibrils from transthyretin protein. The pathological and clinical disease manifestations and the number of pathogenic mutational changes in transthyretin are highly diverse, raising the question whether the different mutations may lead to different fibril morphologies. Using cryo-electron microscopy, however, we show here that the fibril structure is remarkably similar in patients that are affected by different mutations. Our data suggest that the circumstances under which these fibrils are formed and deposited inside the body - and not only the fibril morphology - are crucial for defining the phenotypic variability in many patients. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
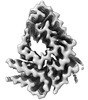
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_17736.map.gz emd_17736.map.gz | 4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-17736-v30.xml emd-17736-v30.xml emd-17736.xml emd-17736.xml | 15 KB 15 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_17736_fsc.xml emd_17736_fsc.xml | 9.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_17736.png emd_17736.png | 92.5 KB | ||
| Filedesc metadata |  emd-17736.cif.gz emd-17736.cif.gz | 5.2 KB | ||
| その他 |  emd_17736_half_map_1.map.gz emd_17736_half_map_1.map.gz emd_17736_half_map_2.map.gz emd_17736_half_map_2.map.gz | 49.6 MB 49.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-17736 http://ftp.pdbj.org/pub/emdb/structures/EMD-17736 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17736 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17736 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_17736_validation.pdf.gz emd_17736_validation.pdf.gz | 786.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_17736_full_validation.pdf.gz emd_17736_full_validation.pdf.gz | 786.4 KB | 表示 | |
| XML形式データ |  emd_17736_validation.xml.gz emd_17736_validation.xml.gz | 16.2 KB | 表示 | |
| CIF形式データ |  emd_17736_validation.cif.gz emd_17736_validation.cif.gz | 21.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17736 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17736 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17736 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17736 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_17736.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_17736.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.822 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_17736_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
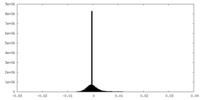
| 投影像・断面図 |
| ||||||||||||
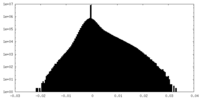
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_17736_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
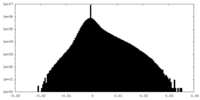
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : ATTRV20I amyloid fibril
| 全体 | 名称: ATTRV20I amyloid fibril |
|---|---|
| 要素 |
|
-超分子 #1: ATTRV20I amyloid fibril
| 超分子 | 名称: ATTRV20I amyloid fibril / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: amyloid fibril of Transthyretin with V20I mutation in hereditary ATTR amyloidosis |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 器官: Heart / 組織: Heart muscle Homo sapiens (ヒト) / 器官: Heart / 組織: Heart muscle |
-分子 #1: Transthyretin
| 分子 | 名称: Transthyretin / タイプ: protein_or_peptide / ID: 1 / 詳細: Amyloid fibril / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 器官: Heart Homo sapiens (ヒト) / 器官: Heart |
| 分子量 | 理論値: 13.791388 KDa |
| 配列 | 文字列: GPTGTGESKC PLMVKVLDAI RGSPAINVAV HVFRKAADDT WEPFASGKTS ESGELHGLTT EEEFVEGIYK VEIDTKSYWK ALGISPFHE HAEVVFTAND SGPRRYTIAA LLSPYSYSTT AVVTNPKE UniProtKB: Transthyretin |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 緩衝液 | pH: 7 / 詳細: Water |
|---|---|
| グリッド | モデル: C-flat-1.2/1.3 / 材質: COPPER / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 295.15 K / 装置: LEICA EM GP |
| 詳細 | amyloid fibril of Transthyretin with V20I mutation |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 3954 / 平均電子線量: 40.33 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー













 Z
Z Y
Y X
X