+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of TolQR complex from E.coli | |||||||||
 マップデータ マップデータ | One of maps used in refinement, Z-flipped for model building. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | TolQ / TolR / Tol-Pal / complex / inner membrane / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of membrane invagination / cell envelope / bacteriocin transport / protein import / cell division site / transmembrane transporter activity / protein transport / cell cycle / cell division / membrane / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |   | |||||||||
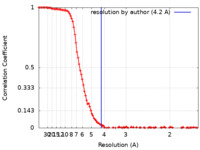
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.2 Å | |||||||||
 データ登録者 データ登録者 | Webby MN / Kleanthous C / Press CE | |||||||||
| 資金援助 |  英国, European Union, 2件 英国, European Union, 2件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2023 ジャーナル: Proc Natl Acad Sci U S A / 年: 2023タイトル: Tunable force transduction through the cell envelope. 著者: Daniel P Williams-Jones / Melissa N Webby / Cara E Press / Jan M Gradon / Sophie R Armstrong / Joanna Szczepaniak / Colin Kleanthous /  要旨: The outer membrane (OM) of Gram-negative bacteria is not energised and so processes requiring a driving force must connect to energy-transduction systems in the inner membrane (IM). Tol (Tol-Pal) and ...The outer membrane (OM) of Gram-negative bacteria is not energised and so processes requiring a driving force must connect to energy-transduction systems in the inner membrane (IM). Tol (Tol-Pal) and Ton are related, proton motive force- (PMF-) coupled assemblies that stabilise the OM and import essential nutrients, respectively. Both rely on proton-harvesting IM motor (stator) complexes, which are homologues of the flagellar stator unit Mot, to transduce force to the OM through elongated IM force transducer proteins, TolA and TonB, respectively. How PMF-driven motors in the IM generate mechanical work at the OM via force transducers is unknown. Here, using cryoelectron microscopy, we report the 4.3Å structure of the TolQR motor complex. The structure reaffirms the 5:2 stoichiometry seen in Ton and Mot and, with motor subunits related to each other by 10 to 16° rotation, supports rotary motion as the default for these complexes. We probed the mechanism of force transduction to the OM through in vivo assays of chimeric TolA/TonB proteins where sections of their structurally divergent, periplasm-spanning domains were swapped or replaced by an intrinsically disordered sequence. We find that TolA mutants exhibit a spectrum of force output, which is reflected in their respective abilities to both stabilise the OM and import cytotoxic colicins across the OM. Our studies demonstrate that structural rigidity of force transducer proteins, rather than any particular structural form, drives the efficient conversion of PMF-driven rotary motions of 5:2 motor complexes into physiologically relevant force at the OM. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16816.map.gz emd_16816.map.gz | 96.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16816-v30.xml emd-16816-v30.xml emd-16816.xml emd-16816.xml | 18.5 KB 18.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16816_fsc.xml emd_16816_fsc.xml | 13.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16816.png emd_16816.png | 51.3 KB | ||
| Filedesc metadata |  emd-16816.cif.gz emd-16816.cif.gz | 5.9 KB | ||
| その他 |  emd_16816_additional_1.map.gz emd_16816_additional_1.map.gz emd_16816_half_map_1.map.gz emd_16816_half_map_1.map.gz emd_16816_half_map_2.map.gz emd_16816_half_map_2.map.gz | 96.9 MB 95.5 MB 95.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16816 http://ftp.pdbj.org/pub/emdb/structures/EMD-16816 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16816 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16816 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16816_validation.pdf.gz emd_16816_validation.pdf.gz | 863.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16816_full_validation.pdf.gz emd_16816_full_validation.pdf.gz | 863.1 KB | 表示 | |
| XML形式データ |  emd_16816_validation.xml.gz emd_16816_validation.xml.gz | 17.9 KB | 表示 | |
| CIF形式データ |  emd_16816_validation.cif.gz emd_16816_validation.cif.gz | 22.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16816 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16816 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16816 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16816 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8odtMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16816.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16816.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | One of maps used in refinement, Z-flipped for model building. | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.832 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Class one, from 3D classification.
| ファイル | emd_16816_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Class one, from 3D classification. | ||||||||||||
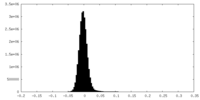
| 投影像・断面図 |
| ||||||||||||
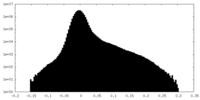
| 密度ヒストグラム |
-ハーフマップ: Half map A
| ファイル | emd_16816_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map A
| ファイル | emd_16816_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : TolQ-TolR 5:2 complex
| 全体 | 名称: TolQ-TolR 5:2 complex |
|---|---|
| 要素 |
|
-超分子 #1: TolQ-TolR 5:2 complex
| 超分子 | 名称: TolQ-TolR 5:2 complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 170 KDa |
-分子 #1: Tol-Pal system protein TolQ
| 分子 | 名称: Tol-Pal system protein TolQ / タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 25.623662 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTDMNILDLF LKASLLVKLI MLILIGFSIA SWAIIIQRTR ILNAAAREAE AFEDKFWSGI ELSRLYQESQ GKRDNLTGSE QIFYSGFKE FVRLHRANSH APEAVVEGAS RAMRISMNRE LENLETHIPF LGTVGSISPY IGLFGTVWGI MHAFIALGAV K QATLQMVA ...文字列: MTDMNILDLF LKASLLVKLI MLILIGFSIA SWAIIIQRTR ILNAAAREAE AFEDKFWSGI ELSRLYQESQ GKRDNLTGSE QIFYSGFKE FVRLHRANSH APEAVVEGAS RAMRISMNRE LENLETHIPF LGTVGSISPY IGLFGTVWGI MHAFIALGAV K QATLQMVA PGIAEALIAT AIGLFAAIPA VMAYNRLNQR VNKLELNYDN FMEEFTAILH RQAFTVSESN KG UniProtKB: Tol-Pal system protein TolQ |
-分子 #2: Tol-Pal system protein TolR
| 分子 | 名称: Tol-Pal system protein TolR / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 20.600367 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MARARGRGRR DLKSEINIVP LLDVLLVLLL IFMATAPIIT QSVEVDLPDA TESQAVSSND NPPVIVEVSG IGQYTVVVEK DRLERLPPE QVVAEVSSRF KANPKTVFLI GGAKDVPYDE IIKALNLLHS AGVKSVGLMT QPILEENLYF QGQFGSWSHP Q FEKGGGSG ...文字列: MARARGRGRR DLKSEINIVP LLDVLLVLLL IFMATAPIIT QSVEVDLPDA TESQAVSSND NPPVIVEVSG IGQYTVVVEK DRLERLPPE QVVAEVSSRF KANPKTVFLI GGAKDVPYDE IIKALNLLHS AGVKSVGLMT QPILEENLYF QGQFGSWSHP Q FEKGGGSG GGSGGGSWSH PQFEKHHHHH H UniProtKB: Tol-Pal system protein TolR |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 7.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 15.0 kPa |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 281 K / 装置: FEI VITROBOT MARK IV / 詳細: Blot force 10 Blot time 3 sec Wait time 2 sec. |
| 詳細 | sample purified by affinity chromatography (His-tagged TolR) and SEC before application to grids in 50 mM Tris/HCl pH 7.5, 300 mM NaCl, 2 mM EDTA, 0.01% LMNG |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 46.39 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー




 Z
Z Y
Y X
X