+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of human mitochondrial RNase Z in complex with mitochondrial pre-tRNA-His(0,Ser) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | RNA maturation / RNA modification / mitochondrial tRNA / RNA methyltransferase / MRPP1 / MRPP2 / MRPP3 / RNA binding protein / m6A / RNA binding / RNA recognition | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報tRNase Z / mitochondrial tRNA processing / tRNA-specific ribonuclease activity / mitochondrial RNA 5'-end processing / brexanolone metabolic process / isoursodeoxycholate 7-beta-dehydrogenase (NAD+) activity / ursodeoxycholate 7-beta-dehydrogenase (NAD+) activity / 3-hydroxy-2-methylbutyryl-CoA dehydrogenase / 3-hydroxy-2-methylbutyryl-CoA dehydrogenase activity / mitochondrial tRNA methylation ...tRNase Z / mitochondrial tRNA processing / tRNA-specific ribonuclease activity / mitochondrial RNA 5'-end processing / brexanolone metabolic process / isoursodeoxycholate 7-beta-dehydrogenase (NAD+) activity / ursodeoxycholate 7-beta-dehydrogenase (NAD+) activity / 3-hydroxy-2-methylbutyryl-CoA dehydrogenase / 3-hydroxy-2-methylbutyryl-CoA dehydrogenase activity / mitochondrial tRNA methylation / rRNA processing in the mitochondrion / tRNA (adenine9-N1)-methyltransferase / tRNA (adenine(9)-N1)-methyltransferase activity / tRNA processing in the mitochondrion / tRNA (guanine9-N1)-methyltransferase / mitochondrial ribonuclease P complex / tRNA (guanosine(9)-N1)-methyltransferase activity / mitochondrial tRNA 5'-end processing / chenodeoxycholate 7-alpha-dehydrogenase (NAD+) activity / mitochondrial tRNA 3'-end processing / tRNA modification in the mitochondrion / 17-beta-hydroxysteroid dehydrogenase (NAD+) activity / 7alpha-hydroxysteroid dehydrogenase / cholate 7-alpha-dehydrogenase activity / C21-steroid hormone metabolic process / 3'-tRNA processing endoribonuclease activity / testosterone dehydrogenase [NAD(P)+] activity / tRNA methyltransferase complex / tRNA 3'-end processing / 3-hydroxyacyl-CoA dehydrogenase / isoleucine catabolic process / 3alpha(17beta)-hydroxysteroid dehydrogenase (NAD+) / tRNA-derived small RNA (tsRNA or tRNA-related fragment, tRF) biogenesis / 3-hydroxyacyl-CoA dehydrogenase activity / tRNA decay / 3alpha(or 20beta)-hydroxysteroid dehydrogenase / androstan-3-alpha,17-beta-diol dehydrogenase activity / bile acid biosynthetic process / testosterone dehydrogenase (NAD+) activity / Branched-chain amino acid catabolism / 17beta-estradiol 17-dehydrogenase / estradiol 17-beta-dehydrogenase [NAD(P)+] activity / positive regulation of mitochondrial translation / tRNA processing in the nucleus / estrogen metabolic process / fatty acid beta-oxidation / mitochondrial nucleoid / androgen metabolic process / Mitochondrial protein degradation / RNA endonuclease activity / 転移酵素; 一炭素原子の基を移すもの; メチル基を移すもの / mitochondrion organization / fatty acid metabolic process / lipid metabolic process / mRNA processing / protein homotetramerization / tRNA binding / mitochondrial matrix / mitochondrion / RNA binding / nucleoplasm / identical protein binding / nucleus / metal ion binding / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.79 Å | |||||||||
 データ登録者 データ登録者 | MEYNIER V / HARDWICK S / CATALA M / ROSKE J / OERUM S / CHIRGADZE D / BARRAUD P / YU W / LUISI B / TISNE C | |||||||||
| 資金援助 |  フランス, 1件 フランス, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structural basis for human mitochondrial tRNA maturation. 著者: Vincent Meynier / Steven W Hardwick / Marjorie Catala / Johann J Roske / Stephanie Oerum / Dimitri Y Chirgadze / Pierre Barraud / Wyatt W Yue / Ben F Luisi / Carine Tisné /   要旨: The human mitochondrial genome is transcribed into two RNAs, containing mRNAs, rRNAs and tRNAs, all dedicated to produce essential proteins of the respiratory chain. The precise excision of tRNAs by ...The human mitochondrial genome is transcribed into two RNAs, containing mRNAs, rRNAs and tRNAs, all dedicated to produce essential proteins of the respiratory chain. The precise excision of tRNAs by the mitochondrial endoribonucleases (mt-RNase), P and Z, releases all RNA species from the two RNA transcripts. The tRNAs then undergo 3'-CCA addition. In metazoan mitochondria, RNase P is a multi-enzyme assembly that comprises the endoribonuclease PRORP and a tRNA methyltransferase subcomplex. The requirement for this tRNA methyltransferase subcomplex for mt-RNase P cleavage activity, as well as the mechanisms of pre-tRNA 3'-cleavage and 3'-CCA addition, are still poorly understood. Here, we report cryo-EM structures that visualise four steps of mitochondrial tRNA maturation: 5' and 3' tRNA-end processing, methylation and 3'-CCA addition, and explain the defined sequential order of the tRNA processing steps. The methyltransferase subcomplex recognises the pre-tRNA in a distinct mode that can support tRNA-end processing and 3'-CCA addition, likely resulting from an evolutionary adaptation of mitochondrial tRNA maturation complexes to the structurally-fragile mitochondrial tRNAs. This subcomplex can also ensure a tRNA-folding quality-control checkpoint before the sequential docking of the maturation enzymes. Altogether, our study provides detailed molecular insight into RNA-transcript processing and tRNA maturation in human mitochondria. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
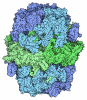
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16544.map.gz emd_16544.map.gz | 392 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16544-v30.xml emd-16544-v30.xml emd-16544.xml emd-16544.xml | 18.3 KB 18.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_16544.png emd_16544.png | 43.8 KB | ||
| Filedesc metadata |  emd-16544.cif.gz emd-16544.cif.gz | 7.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16544 http://ftp.pdbj.org/pub/emdb/structures/EMD-16544 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16544 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16544 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16544_validation.pdf.gz emd_16544_validation.pdf.gz | 499.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16544_full_validation.pdf.gz emd_16544_full_validation.pdf.gz | 499.5 KB | 表示 | |
| XML形式データ |  emd_16544_validation.xml.gz emd_16544_validation.xml.gz | 8.1 KB | 表示 | |
| CIF形式データ |  emd_16544_validation.cif.gz emd_16544_validation.cif.gz | 9.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16544 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16544 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16544 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16544 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16544.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16544.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.652 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Human mitochondrial RNase P in complex with mitochondrial pre-tRN...
| 全体 | 名称: Human mitochondrial RNase P in complex with mitochondrial pre-tRNA-His(0,Ser) |
|---|---|
| 要素 |
|
-超分子 #1: Human mitochondrial RNase P in complex with mitochondrial pre-tRN...
| 超分子 | 名称: Human mitochondrial RNase P in complex with mitochondrial pre-tRNA-His(0,Ser) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1, #3-#4 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 300 KDa |
-分子 #1: 3-hydroxyacyl-CoA dehydrogenase type-2
| 分子 | 名称: 3-hydroxyacyl-CoA dehydrogenase type-2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号: 3-hydroxyacyl-CoA dehydrogenase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 26.947021 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAAACRSVKG LVAVITGGAS GLGLATAERL VGQGASAVLL DLPNSGGEAQ AKKLGNNCVF APADVTSEKD VQTALALAKG KFGRVDVAV NCAGIAVASK TYNLKKGQTH TLEDFQRVLD VNLMGTFNVI RLVAGEMGQN EPDQGGQRGV IINTASVAAF E GQVGQAAY ...文字列: MAAACRSVKG LVAVITGGAS GLGLATAERL VGQGASAVLL DLPNSGGEAQ AKKLGNNCVF APADVTSEKD VQTALALAKG KFGRVDVAV NCAGIAVASK TYNLKKGQTH TLEDFQRVLD VNLMGTFNVI RLVAGEMGQN EPDQGGQRGV IINTASVAAF E GQVGQAAY SASKGGIVGM TLPIARDLAP IGIRVMTIAP GLFGTPLLTS LPEKVCNFLA SQVPFPSRLG DPAEYAHLVQ AI IENPFLN GEVIRLDGAI RMQP UniProtKB: 3-hydroxyacyl-CoA dehydrogenase type-2 |
-分子 #2: Zinc phosphodiesterase ELAC protein 2
| 分子 | 名称: Zinc phosphodiesterase ELAC protein 2 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO / EC番号: tRNase Z |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 92.281047 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MWALCSLLRS AAGRTMSQGR TISQAPARRE RPRKDPLRHL RTREKRGPSG CSGGPNTVYL QVVAAGSRDS GAALYVFSEF NRYLFNCGE GVQRLMQEHK LKVARLDNIF LTRMHWSNVG GLSGMILTLK ETGLPKCVLS GPPQLEKYLE AIKIFSGPLK G IELAVRPH ...文字列: MWALCSLLRS AAGRTMSQGR TISQAPARRE RPRKDPLRHL RTREKRGPSG CSGGPNTVYL QVVAAGSRDS GAALYVFSEF NRYLFNCGE GVQRLMQEHK LKVARLDNIF LTRMHWSNVG GLSGMILTLK ETGLPKCVLS GPPQLEKYLE AIKIFSGPLK G IELAVRPH SAPEYEDETM TVYQIPIHSE QRRGKHQPWQ SPERPLSRLS PERSSDSESN ENEPHLPHGV SQRRGVRDSS LV VAFICKL HLKRGNFLVL KAKEMGLPVG TAAIAPIIAA VKDGKSITHE GREILAEELC TPPDPGAAFV VVECPDESFI QPI CENATF QRYQGKADAP VALVVHMAPA SVLVDSRYQQ WMERFGPDTQ HLVLNENCAS VHNLRSHKIQ TQLNLIHPDI FPLL TSFRC KKEGPTLSVP MVQGECLLKY QLRPRREWQR DAIITCNPEE FIVEALQLPN FQQSVQEYRR SAQDGPAPAE KRSQY PEII FLGTGSAIPM KIRNVSATLV NISPDTSLLL DCGEGTFGQL CRHYGDQVDR VLGTLAAVFV SHLAADHHTG LPSILL QRE RALASLGKPL HPLLVVAPNQ LKAWLQQYHN QCQEVLHHIS MIPAKCLQEG AEISSPAVER LISSLLRTCD LEEFQTC LV RHCKHAFGCA LVHTSGWKVV YSGDTMPCEA LVRMGKDATL LIHEATLEDG LEEEAVEKTH STTSQAISVG MRMNAEFI M LNHFSQRYAK VPLFSPNFSE KVGVAFDHMK VCFGDFPTMP KLIPPLKALF AGDIEEMEER REKRELRQVR AALLSRELA GGLEDGEPQQ KRAHTEEPQA KKVRAQ UniProtKB: Zinc phosphodiesterase ELAC protein 2 |
-分子 #3: tRNA methyltransferase 10 homolog C
| 分子 | 名称: tRNA methyltransferase 10 homolog C / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO EC番号: 転移酵素; 一炭素原子の基を移すもの; メチル基を移すもの |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 48.007793 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MHHHHHHSSG VDLGTENLYF QSMSSKIPAV TYPKNESTPP SEELELDKWK TTMKSSVQEE CVSTISSSKD EDPLAATREF IEMWRLLGR EVPEHITEEE LKTLMECVSN TAKKKYLKYL YTKEKVKKAR QIKKEMKAAA REEAKNIKLL ETTEEDKQKN F LFLRLWDR ...文字列: MHHHHHHSSG VDLGTENLYF QSMSSKIPAV TYPKNESTPP SEELELDKWK TTMKSSVQEE CVSTISSSKD EDPLAATREF IEMWRLLGR EVPEHITEEE LKTLMECVSN TAKKKYLKYL YTKEKVKKAR QIKKEMKAAA REEAKNIKLL ETTEEDKQKN F LFLRLWDR NMDIAMGWKG AQAMQFGQPL VFDMAYENYM KRKELQNTVS QLLESEGWNR RNVDPFHIYF CNLKIDGALH RE LVKRYQE KWDKLLLTST EKSHVDLFPK DSIIYLTADS PNVMTTFRHD KVYVIGSFVD KSMQPGTSLA KAKRLNLATE CLP LDKYLQ WEIGNKNLTL DQMIRILLCL KNNGNWQEAL QFVPKRKHTG FLEISQHSQE FINRLKKAKT AENLYFQSHH HHHH DYKDD DDK UniProtKB: tRNA methyltransferase 10 homolog C |
-分子 #4: Mitochondrial Precursor tRNA-His(0,Ser)
| 分子 | 名称: Mitochondrial Precursor tRNA-His(0,Ser) / タイプ: rna / ID: 4 / コピー数: 1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 40.867301 KDa |
| 配列 | 文字列: GUAAAUAUAG UUUAACCAAA ACAUCAGAUU GUGAAUCUGA CAACAGAGGC UUACGACCCC UUAUUUACCG AGAAAGCUCA CAAGAACUG CUAACUCAUG CCCCCAUGUC UAACAACAUG GCUUUCUCA |
-分子 #5: NICOTINAMIDE-ADENINE-DINUCLEOTIDE
| 分子 | 名称: NICOTINAMIDE-ADENINE-DINUCLEOTIDE / タイプ: ligand / ID: 5 / コピー数: 4 / 式: NAD |
|---|---|
| 分子量 | 理論値: 663.425 Da |
| Chemical component information |  ChemComp-NAD: |
-分子 #6: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 6 / コピー数: 1 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-分子 #7: S-ADENOSYL-L-HOMOCYSTEINE
| 分子 | 名称: S-ADENOSYL-L-HOMOCYSTEINE / タイプ: ligand / ID: 7 / コピー数: 1 / 式: SAH |
|---|---|
| 分子量 | 理論値: 384.411 Da |
| Chemical component information |  ChemComp-SAH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 3 sec. | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV | ||||||||||||
| 詳細 | This sample was monodisperse |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 48.9 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: DIFFRACTION / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 0.9 µm / 倍率(公称値): 130000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 2.79 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 74166 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION / ソフトウェア - 名称: cryoSPARC |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION / ソフトウェア - 名称: cryoSPARC |
-原子モデル構築 1
| 精密化 | プロトコル: AB INITIO MODEL 当てはまり具合の基準: Cross-correllation coefficient |
|---|---|
| 得られたモデル |  PDB-8cbl: |
 ムービー
ムービー コントローラー
コントローラー


























 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)





















