+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | T5 Receptor Binding Protein pb5 in complex with its E. coli receptor FhuA | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | bacteriophage / receptor / complex / RPB / VIRAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報siderophore transmembrane transport / siderophore uptake transmembrane transporter activity / virus tail / virion binding / transmembrane transporter complex / toxic substance binding / cell outer membrane / signaling receptor activity / intracellular iron ion homeostasis / entry receptor-mediated virion attachment to host cell ...siderophore transmembrane transport / siderophore uptake transmembrane transporter activity / virus tail / virion binding / transmembrane transporter complex / toxic substance binding / cell outer membrane / signaling receptor activity / intracellular iron ion homeostasis / entry receptor-mediated virion attachment to host cell / receptor-mediated virion attachment to host cell / iron ion binding / symbiont entry into host cell / protein domain specific binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |   Escherichia virus T5 (ウイルス) / Escherichia virus T5 (ウイルス) /  Escherichia phage T5 (ファージ) Escherichia phage T5 (ファージ) | |||||||||
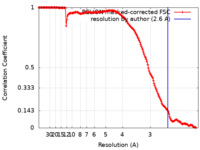
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.6 Å | |||||||||
 データ登録者 データ登録者 | Degroux S / Effantin G / Linares R / Schoehn G / Breyton C | |||||||||
| 資金援助 |  フランス, 2件 フランス, 2件
| |||||||||
 引用 引用 |  ジャーナル: J Virol / 年: 2023 ジャーナル: J Virol / 年: 2023タイトル: Deciphering Bacteriophage T5 Host Recognition Mechanism and Infection Trigger. 著者: Séraphine Degroux / Grégory Effantin / Romain Linares / Guy Schoehn / Cécile Breyton /  要旨: Bacteriophages, viruses infecting bacteria, recognize their host with high specificity, binding to either saccharide motifs or proteins of the cell wall of their host. In the majority of ...Bacteriophages, viruses infecting bacteria, recognize their host with high specificity, binding to either saccharide motifs or proteins of the cell wall of their host. In the majority of bacteriophages, this host recognition is performed by receptor binding proteins (RBPs) located at the extremity of a tail. Interaction between the RBPs and the host is the trigger for bacteriophage infection, but the molecular details of the mechanisms are unknown for most bacteriophages. Here, we present the electron cryomicroscopy (cryo-EM) structure of bacteriophage T5 RBP in complex with its Escherichia coli receptor, the iron ferrichrome transporter FhuA. Monomeric RBP is located at the extremity of T5's long flexible tail, and its irreversible binding to FhuA commits T5 to infection. Analysis of the structure of RBP within the complex, comparison with its AlphaFold2-predicted structure, and its fit into a previously determined map of the T5 tail tip in complex with FhuA allow us to propose a mechanism of transmission of the RBP receptor binding to the straight fiber, initiating the cascade of events that commits T5 to DNA ejection. Tailed bacteriophages specifically recognize their bacterial host by interaction of their receptor binding protein(s) (RBPs) with saccharides and/or proteins located at the surface of their prey. This crucial interaction commits the virus to infection, but the molecular details of this mechanism are unknown for the majority of bacteriophages. We determined the structure of bacteriophage T5 RBP in complex with its E. coli receptor, FhuA, by cryo-EM. This first structure of an RBP bound to its protein receptor allowed us to propose a mechanism of transmission of host recognition to the rest of the phage, ultimately opening the capsid and perforating the cell wall and, thus, allowing safe channeling of the DNA into the host cytoplasm. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15802.map.gz emd_15802.map.gz | 306.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15802-v30.xml emd-15802-v30.xml emd-15802.xml emd-15802.xml | 23.6 KB 23.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15802_fsc.xml emd_15802_fsc.xml | 15.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15802.png emd_15802.png | 77 KB | ||
| マスクデータ |  emd_15802_msk_1.map emd_15802_msk_1.map | 347.6 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-15802.cif.gz emd-15802.cif.gz | 8.1 KB | ||
| その他 |  emd_15802_half_map_1.map.gz emd_15802_half_map_1.map.gz emd_15802_half_map_2.map.gz emd_15802_half_map_2.map.gz | 277.6 MB 277.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15802 http://ftp.pdbj.org/pub/emdb/structures/EMD-15802 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15802 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15802 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15802_validation.pdf.gz emd_15802_validation.pdf.gz | 711.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15802_full_validation.pdf.gz emd_15802_full_validation.pdf.gz | 711.4 KB | 表示 | |
| XML形式データ |  emd_15802_validation.xml.gz emd_15802_validation.xml.gz | 23.7 KB | 表示 | |
| CIF形式データ |  emd_15802_validation.cif.gz emd_15802_validation.cif.gz | 31.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15802 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15802 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15802 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15802 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8b14MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15802.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15802.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.052 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_15802_msk_1.map emd_15802_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_15802_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_15802_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex between T5 Receptor Binding Protein pb5 and its E. coli r...
| 全体 | 名称: Complex between T5 Receptor Binding Protein pb5 and its E. coli receptor FhuA, stabilized with detergent |
|---|---|
| 要素 |
|
-超分子 #1: Complex between T5 Receptor Binding Protein pb5 and its E. coli r...
| 超分子 | 名称: Complex between T5 Receptor Binding Protein pb5 and its E. coli receptor FhuA, stabilized with detergent タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 詳細: The FhuA-pb5 complex was formed by adding equimolar amounts of the two proteins, which results in 100% complex formation. FhuA-RBPpb5 complex is stabilized with 1.6% C10DAO at a protein concentration of 4.3 mg/mL |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 150 KDa |
-超分子 #2: E. coli receptor FhuA
| 超分子 | 名称: E. coli receptor FhuA / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Escherichia virus T5 (ウイルス) Escherichia virus T5 (ウイルス) |
-超分子 #3: T5 Receptor Binding Protein pb5
| 超分子 | 名称: T5 Receptor Binding Protein pb5 / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 |
|---|
-分子 #1: FhuA iron-ferrichrome transporter
| 分子 | 名称: FhuA iron-ferrichrome transporter / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 79.876945 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: AVEPKEDTIT VTAAPAPQES AWGPAATIAA RQSATGTKTD TPIQKVPQSI SVVTAEEMAL HQPKSVKEAL SYTPGVSVGT RGASNTYDH LIIRGFAAEG QSQNNYLNGL KLQGNFYNDA VIDPYMLERA EIMRGPVSVL YGKSSPGGLL NMVSKRPTTE P LKEVQFKA ...文字列: AVEPKEDTIT VTAAPAPQES AWGPAATIAA RQSATGTKTD TPIQKVPQSI SVVTAEEMAL HQPKSVKEAL SYTPGVSVGT RGASNTYDH LIIRGFAAEG QSQNNYLNGL KLQGNFYNDA VIDPYMLERA EIMRGPVSVL YGKSSPGGLL NMVSKRPTTE P LKEVQFKA GTDSLFQTGF DFSDSLDDDG VYSYRLTGLA RSANAQQKGS EEQRYAIAPA FTWRPDDKTN FTFLSYFQNE PE TGYYGWL PKEGTVEPLP NGKRLPTDFN EGAKNNTYSR NEKMVGYSFD HEFNDTFTVR QNLRFAENKT SQNSVYGYGV CSD PANAYS KQCAALAPAD KGHYLARKYV VDDEKLQNFS VDTQLQSKFA TGDIDHTLLT GVDFMRMRND INAWFGYDDS VPLL NLYNP SHHHHHHGSV NTDFDFNAKD PANSGPYRIL NKQKQTGVYV QDQAQWDKVL VTLGGRYDWA DQESLNRVAG TTDKR DDKQ FTWRGGVNYL FDNGVTPYFS YSESFEPSSQ VGKDGNIFAP SKGKQYEVGV KYVPEDRPIV VTGAVYNLTK TNNLMA DPE GSFFSVEGGE IRARGVEIEA KAALSASVNV VGSYTYTDAE YTTDTTYKGN TPAQVPKHMA SLWADYTFFD GPLSGLT LG TGGRYTGSSY GDPANSFKVG SYTVVDALVR YDLARVGMAG SNVALHVNNL FDREYVASCF NTYGCFWGAE RQVVATAT F RF UniProtKB: Ferrichrome outer membrane transporter/phage receptor |
-分子 #2: pb5 bacteriophage T5 receptor binding protein
| 分子 | 名称: pb5 bacteriophage T5 receptor binding protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Escherichia phage T5 (ファージ) Escherichia phage T5 (ファージ) |
| 分子量 | 理論値: 68.782562 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSFFAGKLNN KSILSLRRGS GGDTNQHINP DSQTIFHSDM SHVIITETHS TGLRLDQGAG DYYWSEMPSR VTQLHNNDPN RVVLTEIEF SDGSRHMLSG MSMGVGAKAY GIINPQIMSQ GGLKTQITAS ADLSLDVGYF NTGTSGTIPQ KLRDGTGCQH M FGAFSGRR ...文字列: MSFFAGKLNN KSILSLRRGS GGDTNQHINP DSQTIFHSDM SHVIITETHS TGLRLDQGAG DYYWSEMPSR VTQLHNNDPN RVVLTEIEF SDGSRHMLSG MSMGVGAKAY GIINPQIMSQ GGLKTQITAS ADLSLDVGYF NTGTSGTIPQ KLRDGTGCQH M FGAFSGRR GFASSAMYLG GAALYKSAWS GSGYVVADAG TLTIPSDYVR HPGARNFGFN AIYVRGRSCN RVLYGMEGPN YT TGGAVQG ASSSGALNFT YNPSNPESPK YSVGFARADP TNYAYWESMG DPNDSANGPI GIYSEHLGIY PSKITWYVTN LVY NGSGYN IDGGLFNGND IKLSPREFII KGVNVNNTSW KFINFIEKNF NVGNRADFRD VGCNLSKDSP STGISGIATF GLPT TESNN APSIKGGNVG GLHANVVSIY NFLPSASWYV SSNPPKIGNN YGDVWSENLL PLRLLGGSGS TILSGNIVFQ GNGSV HVGT VGLDLNSSRN GAIVCTMEFI DDTWLSAGGI GCFNPTEMLS QGAEYGDSRF RIGGNTINKK LHQILSLPAG EYVPFF TIK GTVVNACKLQ AAAYNPTPYW VSGLPGSVGQ TGYYTLTYYM RNDGNNNISI WLDSSMSNII GMKACLPNIK LIIQRLT UniProtKB: Receptor-binding protein pb5 |
-分子 #3: DECYLAMINE-N,N-DIMETHYL-N-OXIDE
| 分子 | 名称: DECYLAMINE-N,N-DIMETHYL-N-OXIDE / タイプ: ligand / ID: 3 / コピー数: 1 / 式: DDQ |
|---|---|
| 分子量 | 理論値: 201.349 Da |
| Chemical component information | 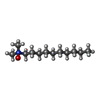 ChemComp-DDQ: |
-分子 #4: [(2R,3S,4R,5R,6R)-2-[[(2R,4R,5R,6R)-6-[(1R)-1,2-bis(oxidanyl)ethy...
| 分子 | 名称: [(2R,3S,4R,5R,6R)-2-[[(2R,4R,5R,6R)-6-[(1R)-1,2-bis(oxidanyl)ethyl]-4-[(2R,4R,5R,6R)-6-[(1R)-1,2-bis(oxidanyl)ethyl]-2-carboxy-4,5-bis(oxidanyl)oxan-2-yl]oxy-2-carboxy-5-oxidanyl-oxan-2-yl] ...名称: [(2R,3S,4R,5R,6R)-2-[[(2R,4R,5R,6R)-6-[(1R)-1,2-bis(oxidanyl)ethyl]-4-[(2R,4R,5R,6R)-6-[(1R)-1,2-bis(oxidanyl)ethyl]-2-carboxy-4,5-bis(oxidanyl)oxan-2-yl]oxy-2-carboxy-5-oxidanyl-oxan-2-yl]oxymethyl]-5-[[(3R)-3-dodecanoyloxytetradecanoyl]amino]-4-(3-nonanoyloxypropanoyloxy)-6-[[(2R,3S,4R,5R,6R)-3-oxidanyl-4-[(3S)-3-oxidanyltetradecanoyl]oxy-5-[[(3R)-3-oxidanyltridecanoyl]amino]-6-phosphonatooxy-oxan-2-yl]methoxy]oxan-3-yl] phosphate タイプ: ligand / ID: 4 / コピー数: 1 / 式: LU9 |
|---|---|
| 分子量 | 理論値: 1.996235 KDa |
| Chemical component information |  ChemComp-LU9: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.11111111111111 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8.5 / 構成要素:
| |||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER/RHODIUM / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 詳細: 25 mA | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 293.15 K / 装置: FEI VITROBOT MARK IV 詳細: 3.5 microliters of the FhuA-pb5 complex were deposited on a freshly glow discharged (25 mA, 30 sec) Cu/Rh 400 mesh Quantifoil R 2/1 EM grids and flash-frozen in nitrogen-cooled liquid ethane ...詳細: 3.5 microliters of the FhuA-pb5 complex were deposited on a freshly glow discharged (25 mA, 30 sec) Cu/Rh 400 mesh Quantifoil R 2/1 EM grids and flash-frozen in nitrogen-cooled liquid ethane using a ThermoFisher Mark IV Vitrobot device (100% humidity, 293.15K, 2s blotting time, blot force 1).. | |||||||||
| 詳細 | The FhuA-pb5 complex was formed by adding equimolar amounts of the two proteins, which results in 100% complex formation. FhuA-RBPpb5 complex is stabilized with 1.6% C10DAO at a protein concentration of 4.3 mg/ml |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 詳細 | calibrated pixel size = 1.052 |
| 撮影 | #0 - Image recording ID: 1 #0 - フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) #0 - 検出モード: COUNTING / #0 - 撮影したグリッド数: 1 / #0 - 実像数: 8752 / #0 - 平均電子線量: 60.0 e/Å2 / #1 - Image recording ID: 2 #1 - フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) #1 - 検出モード: COUNTING / #1 - 撮影したグリッド数: 1 / #1 - 実像数: 777 / #1 - 平均電子線量: 60.0 e/Å2 #1 - 詳細: Unlike the first dataset, this one was acquired with a phase plate, close to focus (between -0.5 and -1.0 micrometer). |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.6 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| 詳細 | The pb5 protein model was built de novo in the cryo-electron microscopy map. FhuA was adapted from the FhuA structure solved by X-ray crystallography (PDB 2GRX). The two structures were first refined separately using Coot (version 0.9.2) and Phenix (version 1.18.2-3874) softwares, then together. Structure validation was done using MolProbity. |
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL |
| 得られたモデル |  PDB-8b14: |
 ムービー
ムービー コントローラー
コントローラー




 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)