+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM reconstruction of the augmin TIII subcomplex | |||||||||
 マップデータ マップデータ | Cryo-EM reconstruction of the augmin TIII subcomplex | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Microtubule / Branching / Nucleation / CELL CYCLE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報HAUS complex / mitotic spindle microtubule / centrosome cycle / spindle assembly / spindle / microtubule / cell division / centrosome / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 | ||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 7.7 Å | |||||||||
 データ登録者 データ登録者 | Zupa E / Pfeffer S | |||||||||
| 資金援助 |  ドイツ, 2件 ドイツ, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: The augmin complex architecture reveals structural insights into microtubule branching. 著者: Erik Zupa / Martin Würtz / Annett Neuner / Thomas Hoffmann / Mandy Rettel / Anna Böhler / Bram J A Vermeulen / Sebastian Eustermann / Elmar Schiebel / Stefan Pfeffer /  要旨: In mitosis, the augmin complex binds to spindle microtubules to recruit the γ-tubulin ring complex (γ-TuRC), the principal microtubule nucleator, for the formation of branched microtubules. Our ...In mitosis, the augmin complex binds to spindle microtubules to recruit the γ-tubulin ring complex (γ-TuRC), the principal microtubule nucleator, for the formation of branched microtubules. Our understanding of augmin-mediated microtubule branching is hampered by the lack of structural information on the augmin complex. Here, we elucidate the molecular architecture and conformational plasticity of the augmin complex using an integrative structural biology approach. The elongated structure of the augmin complex is characterised by extensive coiled-coil segments and comprises two structural elements with distinct but complementary functions in γ-TuRC and microtubule binding, linked by a flexible hinge. The augmin complex is recruited to microtubules via a composite microtubule binding site comprising a positively charged unordered extension and two calponin homology domains. Our study provides the structural basis for augmin function in branched microtubule formation, decisively fostering our understanding of spindle formation in mitosis. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15631.map.gz emd_15631.map.gz | 51.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15631-v30.xml emd-15631-v30.xml emd-15631.xml emd-15631.xml | 22.2 KB 22.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_15631.png emd_15631.png | 26.8 KB | ||
| Filedesc metadata |  emd-15631.cif.gz emd-15631.cif.gz | 7.3 KB | ||
| その他 |  emd_15631_half_map_1.map.gz emd_15631_half_map_1.map.gz emd_15631_half_map_2.map.gz emd_15631_half_map_2.map.gz | 50.5 MB 50.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15631 http://ftp.pdbj.org/pub/emdb/structures/EMD-15631 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15631 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15631 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15631_validation.pdf.gz emd_15631_validation.pdf.gz | 787.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15631_full_validation.pdf.gz emd_15631_full_validation.pdf.gz | 787 KB | 表示 | |
| XML形式データ |  emd_15631_validation.xml.gz emd_15631_validation.xml.gz | 12.2 KB | 表示 | |
| CIF形式データ |  emd_15631_validation.cif.gz emd_15631_validation.cif.gz | 14.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15631 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15631 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15631 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15631 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15631.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15631.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM reconstruction of the augmin TIII subcomplex | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.14 Å | ||||||||||||||||||||||||||||||||||||
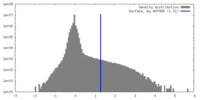
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Cryo-EM reconstruction of the augmin TIII subcomplex-half map A
| ファイル | emd_15631_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM reconstruction of the augmin TIII subcomplex-half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
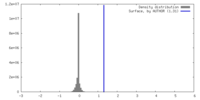
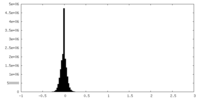
| 密度ヒストグラム |
-ハーフマップ: Cryo-EM reconstruction of the augmin TIII subcomplex-half map B
| ファイル | emd_15631_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM reconstruction of the augmin TIII subcomplex-half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
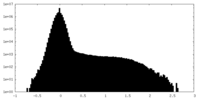
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Augmin TIII subcomplex
| 全体 | 名称: Augmin TIII subcomplex |
|---|---|
| 要素 |
|
-超分子 #1: Augmin TIII subcomplex
| 超分子 | 名称: Augmin TIII subcomplex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 218 KDa |
-分子 #1: HAUS augmin-like complex subunit 1
| 分子 | 名称: HAUS augmin-like complex subunit 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 32.684684 KDa |
| 組換発現 | 生物種:  Spodoptera aff. frugiperda 1 BOLD-2017 (蝶・蛾) Spodoptera aff. frugiperda 1 BOLD-2017 (蝶・蛾) |
| 配列 | 文字列: MDEKSTKIIM WLKKMFGDKP LPPYEVNTRT MEILYQLAEW NEARDKDLSL VTEDLKLKSA EVKAEAKYLQ DLLTEGLGPS YTNLSRMGN NYLNQIVDSC LALELKNSSL SSYIPAVNDL SSELVAIELN NQEMEAELTS LRKKLTEALV LEKSLERDLK K AEEQCNFE ...文字列: MDEKSTKIIM WLKKMFGDKP LPPYEVNTRT MEILYQLAEW NEARDKDLSL VTEDLKLKSA EVKAEAKYLQ DLLTEGLGPS YTNLSRMGN NYLNQIVDSC LALELKNSSL SSYIPAVNDL SSELVAIELN NQEMEAELTS LRKKLTEALV LEKSLERDLK K AEEQCNFE KAKVEIRSQN MKKLKDKSEE YKYKIHAAKD QLSSAGMEEP LTHRSLVSLS ETLTELKAQS MAAKEKLNSY LD LAPNPSL VKVKIEEAKR ELKATEVELT TKVNMMEFVV PEPSKRRLK UniProtKB: LOC495502 protein |
-分子 #2: HAUS augmin-like complex subunit 3
| 分子 | 名称: HAUS augmin-like complex subunit 3 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 68.11225 KDa |
| 組換発現 | 生物種:  Spodoptera aff. frugiperda 1 BOLD-2017 (蝶・蛾) Spodoptera aff. frugiperda 1 BOLD-2017 (蝶・蛾) |
| 配列 | 文字列: MSGGDRFVQT LQKLNYPKGA QLDGEDFDWL FEAVDLKPFL DWFCSAASEQ NVVPDEKLQA FNTLKESGKP VLDEKALDEV LKTFSISKV PAIEEVAIEK LEEEVKALQK QKNLHIRRRN KLQMVESGNR QMCLKSKDKE EETGRAFQEV LHLLRVTNKK L NHELQSIV ...文字列: MSGGDRFVQT LQKLNYPKGA QLDGEDFDWL FEAVDLKPFL DWFCSAASEQ NVVPDEKLQA FNTLKESGKP VLDEKALDEV LKTFSISKV PAIEEVAIEK LEEEVKALQK QKNLHIRRRN KLQMVESGNR QMCLKSKDKE EETGRAFQEV LHLLRVTNKK L NHELQSIV NGVQTLMSFF STPETACELS SQPIFLSQLL LDKYLSLEEQ STAALTSFTK EHFFEGMSKF VEGSDENFQL VQ LNVNSFG EDGTTEDKCK EMMRLQLAYI CAKHKLIQMK AKSASLKVGL QWAENNASVV QDKASQKEEN LKVRITSLKN ETL QIENHT NSISNEKLPG LVRDNAQLLN MPIVKGDYDL QMAHQTSCSS RQDLVCDHLM KQKASFELLQ LGYELELRKH RDVY RELGS IVQELKESGD KLEERLTMLS DVNLLSASKP RSNIDSKDLT SHRLYQLLDG DNTQKLFRTY DGLESVAQKL SQDIA SMRD QLEVSEQEHS LLLSKLDSHL KELRDFMYPE GNTLMLTTPE LSGEFHQLGS QLEKLNHITV EILGDLQLKR KMLESN KLQ QIEKQLYVYF FQNEEQLKSI VGKLEAQTGG GSSA UniProtKB: HAUS augmin-like complex subunit 3 |
-分子 #3: HAUS augmin like complex subunit 4 L homeolog
| 分子 | 名称: HAUS augmin like complex subunit 4 L homeolog / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 41.256438 KDa |
| 組換発現 | 生物種:  Spodoptera aff. frugiperda 1 BOLD-2017 (蝶・蛾) Spodoptera aff. frugiperda 1 BOLD-2017 (蝶・蛾) |
| 配列 | 文字列: MAQTLQYVSS RLSMLQIDEE DLERNAQFGK VLIELCPLLG PNGGSANLNR ELEETRRELL LQRKMWMRSE VIYQLVQEML LDLQVRKLE GSLTEEERKF QDGLQQCMLV SECSRLLTAD SVPPSDSTSI LGLDKQDLLD LLPPNMLVLW VRDRLQKQLE E ALKKKCFT ...文字列: MAQTLQYVSS RLSMLQIDEE DLERNAQFGK VLIELCPLLG PNGGSANLNR ELEETRRELL LQRKMWMRSE VIYQLVQEML LDLQVRKLE GSLTEEERKF QDGLQQCMLV SECSRLLTAD SVPPSDSTSI LGLDKQDLLD LLPPNMLVLW VRDRLQKQLE E ALKKKCFT FLSFHQPETD EEGDVLRAAK VLRLASTLED EKRRLQNEQE KHQEMRALLE KQQEIYPHVL LRCLSLLRQA AS ELRLRAQ SDIDRINAEY LEAKSNALFL KLRMEELQVL TDCYTPEKVL VHRQIRDTLE AGVKKEKQEL STSRQILSSY EFL GPEFEG LVQEYTRLKD KIKDNRWMLQ ELSKSLP UniProtKB: HAUS augmin like complex subunit 4 L homeolog |
-分子 #4: HAUS augmin-like complex subunit 5
| 分子 | 名称: HAUS augmin-like complex subunit 5 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 77.357281 KDa |
| 組換発現 | 生物種:  Spodoptera aff. frugiperda 1 BOLD-2017 (蝶・蛾) Spodoptera aff. frugiperda 1 BOLD-2017 (蝶・蛾) |
| 配列 | 文字列: MERRSLAQEL KKWAVEEMGL PAQKAPSEEM LQRLFIGQCG DIWKFIIRHI HSHRTVRKIE GNLLWYQQLQ HTEAQRTAEE EQQQRRKQL CKEILELRAE LHHLQEQIQT AEREIVGQDL NCERAQDLCR RSLLLRAFNK KREEECEALC QSNKKIQYRC E QLQEIRRA ...文字列: MERRSLAQEL KKWAVEEMGL PAQKAPSEEM LQRLFIGQCG DIWKFIIRHI HSHRTVRKIE GNLLWYQQLQ HTEAQRTAEE EQQQRRKQL CKEILELRAE LHHLQEQIQT AEREIVGQDL NCERAQDLCR RSLLLRAFNK KREEECEALC QSNKKIQYRC E QLQEIRRA SQREVMFSAV DPDLSSSTFL EPEVLRDVRE VCKLRFKFLR SLHDDSISSS VHPGKEDLRS LSHQQWMSMA EK VWNTHTP NHILAALERL TLNSTQELKK LQFSQAADLS KGPSCQLKEF SEPITQSRSC NESTHLDPQE TLPSFHSLIQ EGW ANSVKV SSELRRVQSQ AQALSEHLAE RIQEIHKKLS DGSEVSVLTR AAFDAELRCV ILRGCRDALM QECRMLQEEA AGKK QEMKL LQQQQQNIQE ACLLLDKKQK HIQILIKGNS SSKSQIRRSS VEAQKYVQDK LLPWPQEIIQ ESQRLQDSIQ KEVKH FSAI CLPALLKVST DGFNLLPSRE LSINRMSNTH APYYGIFKGI YESVRLPLYK APESVLSHVA DMKKQLFFLR SQLSSR SEA ISKTQRALQK NTNPDTDALL KSLSDHYSLE LDEMVPKMQR LIQQCEKHQE YGKEVQATVM DWWEQPVQLC LPSEERG GL TLRQWRERWT VAVTALQRAT GSRS UniProtKB: HAUS augmin-like complex subunit 5 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: CONTINUOUS / 支持フィルム - Film thickness: 0.2 / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: OTHER |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 85 % / チャンバー内温度: 298 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 12615 / 平均電子線量: 69.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
|---|---|
| 得られたモデル |  PDB-8at2: |
 ムービー
ムービー コントローラー
コントローラー








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)