+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 3 A CRYO-EM STRUCTURE OF MYCOBACTERIUM TUBERCULOSIS FERRITIN FROM TIMEPIX3 detector | |||||||||
 マップデータ マップデータ | The map is sharpened by Locspiral. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | IRON STORAGE / FERROXIDASE / BACTERIAL FERRITIN / OCTAHEDRAL SYMMETRY. / METAL TRANSPORT | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Mtb iron assimilation by chelation / response to nitrosative stress / encapsulin nanocompartment / iron ion sequestering activity / ferroxidase / ferroxidase activity / intracellular sequestering of iron ion / ferric iron binding / peptidoglycan-based cell wall / ferrous iron binding ...Mtb iron assimilation by chelation / response to nitrosative stress / encapsulin nanocompartment / iron ion sequestering activity / ferroxidase / ferroxidase activity / intracellular sequestering of iron ion / ferric iron binding / peptidoglycan-based cell wall / ferrous iron binding / iron ion transport / response to hypoxia / extracellular region / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Mycobacterium tuberculosis H37Rv (結核菌) Mycobacterium tuberculosis H37Rv (結核菌) | |||||||||
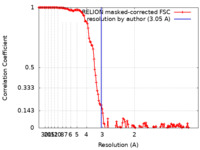
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.05 Å | |||||||||
 データ登録者 データ登録者 | Zhang Y / van Schayck JP / Knoops K / Peters PJ / Ravelli RBG | |||||||||
| 資金援助 |  オランダ, European Union, 2件 オランダ, European Union, 2件
| |||||||||
 引用 引用 |  ジャーナル: Acta Crystallogr D Struct Biol / 年: 2021 ジャーナル: Acta Crystallogr D Struct Biol / 年: 2021タイトル: Mycobacterium tuberculosis ferritin: a suitable workhorse protein for cryo-EM development. 著者: Abril Gijsbers / Yue Zhang / Ye Gao / Peter J Peters / Raimond B G Ravelli /  要旨: The use of cryo-EM continues to expand worldwide and calls for good-quality standard proteins with simple protocols for their production. Here, a straightforward expression and purification protocol ...The use of cryo-EM continues to expand worldwide and calls for good-quality standard proteins with simple protocols for their production. Here, a straightforward expression and purification protocol is presented that provides an apoferritin, bacterioferritin B (BfrB), from Mycobacterium tuberculosis with high yield and purity. A 2.12 Å resolution cryo-EM structure of BfrB is reported, showing the typical cage-like oligomer constituting of 24 monomers related by 432 symmetry. However, it also contains a unique C-terminal extension (164-181), which loops into the cage region of the shell and provides extra stability to the protein. Part of this region was ambiguous in previous crystal structures but could be built within the cryo-EM map. These findings and this protocol could serve the growing cryo-EM community in characterizing and pushing the limits of their electron microscopes and workflows. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15389.map.gz emd_15389.map.gz | 37 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15389-v30.xml emd-15389-v30.xml emd-15389.xml emd-15389.xml | 22.7 KB 22.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15389_fsc.xml emd_15389_fsc.xml | 13.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15389.png emd_15389.png | 81.1 KB | ||
| マスクデータ |  emd_15389_msk_1.map emd_15389_msk_1.map | 229.8 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-15389.cif.gz emd-15389.cif.gz | 6.2 KB | ||
| その他 |  emd_15389_additional_1.map.gz emd_15389_additional_1.map.gz emd_15389_half_map_1.map.gz emd_15389_half_map_1.map.gz emd_15389_half_map_2.map.gz emd_15389_half_map_2.map.gz | 214.8 MB 175.9 MB 175.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15389 http://ftp.pdbj.org/pub/emdb/structures/EMD-15389 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15389 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15389 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15389_validation.pdf.gz emd_15389_validation.pdf.gz | 916.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15389_full_validation.pdf.gz emd_15389_full_validation.pdf.gz | 916.5 KB | 表示 | |
| XML形式データ |  emd_15389_validation.xml.gz emd_15389_validation.xml.gz | 22 KB | 表示 | |
| CIF形式データ |  emd_15389_validation.cif.gz emd_15389_validation.cif.gz | 28.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15389 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15389 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15389 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15389 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8aeyMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15389.map.gz / 形式: CCP4 / 大きさ: 229.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15389.map.gz / 形式: CCP4 / 大きさ: 229.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | The map is sharpened by Locspiral. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.6 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_15389_msk_1.map emd_15389_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: The map is sharpened by Relion postprocessing.
| ファイル | emd_15389_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | The map is sharpened by Relion postprocessing. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_15389_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_15389_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : MYCOBACTERIUM TUBERCULOSIS FERRITIN
| 全体 | 名称: MYCOBACTERIUM TUBERCULOSIS FERRITIN |
|---|---|
| 要素 |
|
-超分子 #1: MYCOBACTERIUM TUBERCULOSIS FERRITIN
| 超分子 | 名称: MYCOBACTERIUM TUBERCULOSIS FERRITIN / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 / 詳細: MYCOBACTERIUM TUBERCULOSIS FERRITIN |
|---|---|
| 由来(天然) | 生物種:  Mycobacterium tuberculosis H37Rv (結核菌) Mycobacterium tuberculosis H37Rv (結核菌) |
-分子 #1: Ferritin BfrB
| 分子 | 名称: Ferritin BfrB / タイプ: protein_or_peptide / ID: 1 / コピー数: 24 / 光学異性体: LEVO / EC番号: ferroxidase |
|---|---|
| 由来(天然) | 生物種:  Mycobacterium tuberculosis H37Rv (結核菌) Mycobacterium tuberculosis H37Rv (結核菌) |
| 分子量 | 理論値: 20.463936 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTEYEGPKTK FHALMQEQIH NEFTAAQQYV AIAVYFDSED LPQLAKHFYS QAVEERNHAM MLVQHLLDRD LRVEIPGVDT VRNQFDRPR EALALALDQE RTVTDQVGRL TAVARDEGDF LGEQFMQWFL QEQIEEVALM ATLVRVADRA GANLFELENF V AREVDVAP AASGAPHAAG GRL UniProtKB: Bacterioferritin BfrB |
-分子 #2: water
| 分子 | 名称: water / タイプ: ligand / ID: 2 / コピー数: 240 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 40 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 50 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI ARCTICA |
|---|---|
| ソフトウェア | 名称: SerialEM (ver. 4.0) |
| 詳細 | BASIC DIRECT ALIGNMENTS WERE DONE AS WELL AS ASTIGMATISM AND COMA ALIGNMENT USING AUTOCTF |
| 撮影 | フィルム・検出器のモデル: OTHER / デジタル化 - サイズ - 横: 512 pixel / デジタル化 - サイズ - 縦: 512 pixel / 実像数: 2977 / 平均露光時間: 1.5 sec. / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm 最大 デフォーカス(公称値): 1.4000000000000001 µm 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 215000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)