+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of trimeric SlpA outer membrane protein | ||||||||||||
 マップデータ マップデータ | RELION PostProcessed map with B-factor sharpening | ||||||||||||
 試料 試料 |
| ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報porin activity / pore complex / monoatomic ion transport / cell outer membrane / lipid binding 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Deinococcus radiodurans (放射線耐性) Deinococcus radiodurans (放射線耐性) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.25 Å | ||||||||||||
 データ登録者 データ登録者 | von Kuegelgen A / Bharat TAM | ||||||||||||
| 資金援助 |  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2022 ジャーナル: Proc Natl Acad Sci U S A / 年: 2022タイトル: A multidomain connector links the outer membrane and cell wall in phylogenetically deep-branching bacteria. 著者: Andriko von Kügelgen / Sofie van Dorst / Vikram Alva / Tanmay A M Bharat /   要旨: is a phylogenetically deep-branching extremophilic bacterium that is remarkably tolerant to numerous environmental stresses, including large doses of ultraviolet (UV) radiation and extreme ... is a phylogenetically deep-branching extremophilic bacterium that is remarkably tolerant to numerous environmental stresses, including large doses of ultraviolet (UV) radiation and extreme temperatures. It can even survive in outer space for several years. This endurance of has been partly ascribed to its atypical cell envelope comprising an inner membrane, a large periplasmic space with a thick peptidoglycan (PG) layer, and an outer membrane (OM) covered by a surface layer (S-layer). Despite intense research, molecular principles governing envelope organization and OM stabilization are unclear in and related bacteria. Here, we report a electron cryomicroscopy (cryo-EM) structure of the abundant OM protein SlpA, showing how its C-terminal segment forms homotrimers of 30-stranded β-barrels in the OM, whereas its N-terminal segment forms long, homotrimeric coiled coils linking the OM to the PG layer via S-layer homology (SLH) domains. Furthermore, using protein structure prediction and sequence-based bioinformatic analysis, we show that SlpA-like putative OM-PG connector proteins are widespread in phylogenetically deep-branching Gram-negative bacteria. Finally, combining our atomic structures with fluorescence and electron microscopy of cell envelopes of wild-type and mutant bacterial strains, we report a model for the cell surface of . Our results will have important implications for understanding the cell surface organization and hyperstability of and related bacteria and the evolutionary transition between Gram-negative and Gram-positive bacteria. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15378.map.gz emd_15378.map.gz | 116.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15378-v30.xml emd-15378-v30.xml emd-15378.xml emd-15378.xml | 25.8 KB 25.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_15378.png emd_15378.png | 184.4 KB | ||
| マスクデータ |  emd_15378_msk_1.map emd_15378_msk_1.map | 125 MB |  マスクマップ マスクマップ | |
| その他 |  emd_15378_additional_1.map.gz emd_15378_additional_1.map.gz emd_15378_half_map_1.map.gz emd_15378_half_map_1.map.gz emd_15378_half_map_2.map.gz emd_15378_half_map_2.map.gz | 115.7 MB 116 MB 116 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15378 http://ftp.pdbj.org/pub/emdb/structures/EMD-15378 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15378 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15378 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15378_validation.pdf.gz emd_15378_validation.pdf.gz | 917.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15378_full_validation.pdf.gz emd_15378_full_validation.pdf.gz | 916.7 KB | 表示 | |
| XML形式データ |  emd_15378_validation.xml.gz emd_15378_validation.xml.gz | 13.8 KB | 表示 | |
| CIF形式データ |  emd_15378_validation.cif.gz emd_15378_validation.cif.gz | 16.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15378 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15378 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15378 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15378 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8ae1MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15378.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15378.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | RELION PostProcessed map with B-factor sharpening | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.092 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_15378_msk_1.map emd_15378_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
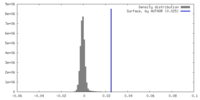
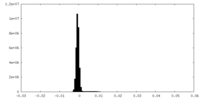
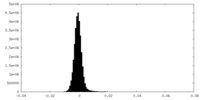
| 密度ヒストグラム |
-追加マップ: Full map RELION without B-factor sharpening
| ファイル | emd_15378_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Full map RELION without B-factor sharpening | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
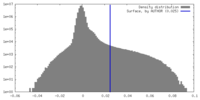
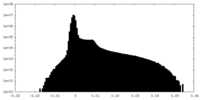
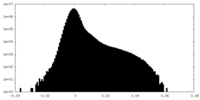
| 密度ヒストグラム |
-ハーフマップ: RELION Half map 1
| ファイル | emd_15378_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | RELION Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
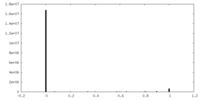
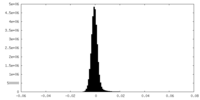
| 密度ヒストグラム |
-ハーフマップ: RELION Half map 1
| ファイル | emd_15378_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | RELION Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
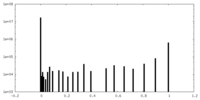
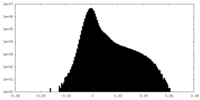
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Structure of trimeric SlpA protein
| 全体 | 名称: Structure of trimeric SlpA protein |
|---|---|
| 要素 |
|
-超分子 #1: Structure of trimeric SlpA protein
| 超分子 | 名称: Structure of trimeric SlpA protein / タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: #1 / 詳細: Structure of trimeric SlpA protein |
|---|---|
| 由来(天然) | 生物種:  Deinococcus radiodurans (放射線耐性) / 株: BAA-816 Deinococcus radiodurans (放射線耐性) / 株: BAA-816 |
-分子 #1: S-layer protein SlpA
| 分子 | 名称: S-layer protein SlpA / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Deinococcus radiodurans (放射線耐性) Deinococcus radiodurans (放射線耐性)株: ATCC 13939 / DSM 20539 / JCM 16871 / LMG 4051 / NBRC 15346 / NCIMB 9279 / R1 / VKM B-1422 |
| 分子量 | 理論値: 123.835367 KDa |
| 配列 | 文字列: MKKSLIALTT ALSFGLAAAQ TAAPVSAPQV PALTDVPAGH WAKDAIDRLV SRGVILGYPD GTFRGTQNLT RYEAAIIIAR LLDQMRDGE TPAGMTAEDM TALQNAIQEL AADLAALGVR VSDLEANAVS KDDFARLEAR IEEVAAAGGE QGATEALQGQ I DDLTARVD ...文字列: MKKSLIALTT ALSFGLAAAQ TAAPVSAPQV PALTDVPAGH WAKDAIDRLV SRGVILGYPD GTFRGTQNLT RYEAAIIIAR LLDQMRDGE TPAGMTAEDM TALQNAIQEL AADLAALGVR VSDLEANAVS KDDFARLEAR IEEVAAAGGE QGATEALQGQ I DDLTARVD EYDALRADVD DNASSIAALN DLTVLLNQDI LDLQDRVSAV EAAQADFVQR SDFDALGGRV TTVETRVETV NN SLTGRIA ALERNAFSVK PSLTIGYSVS RTSRNFDVDR LFPLNADGTV ANNAFTSGGI DTDTGAQRRD FGDFGNASDP VVA GAAGLY GFADGVSYTV YFTDGSTATF DGLNPADYKV PTGKVIDTTK GRNGFGFNNL ARYKEGSTDI GISLGFDTSG QFSQ VTSGT GGSLFSTAGR LQVNQIDLNF GLVTGLPSDA YVDTNGNGKK DDGEATGRGT YLGSGGTAAI LRDPAGNVYR PVFFR FKNA TTQFSVGNNP VIVTLGQQQK FYFSDYVFDN NYDGRGDGFT VTVDGSNVPV IGAWKPQIKG VYGSRSGLDG TAEAGY GVY YRGVRAQITP VGTLTAGIHY AQEGRDMFGA AQNTTSTPSD VTTYGADLHG KAFGVELHSE YATSRVRPNT ANAAVQT SN AFYARVATRK DNLAFDLNTP AAKFGNDTFG VSLYDLNYRK IDAGYNNVAG ISEYGYGSYS RTSAQNIAYN PDTGVTAP F ANLDRQAYTD ANNDGTSDRN ADGTVVATNT KIGQMGFGVK AAANLGPVAI GGYYDTSTGA NGDNANRMTE AGGSAKVAY SIFSLRGTYN TLDSNRPQIY RDAAGTQIIG DAKVRRYAVQ ADVTPGLGLF VGAYYRDVNV NGVRSTTDRG LLGRGYLASS FEPGVGNNA YRTGLRCADN NFGTGTRDID GVGGVLNPAV NLDQSRTATC FTSYGVEAGH AGDNANALVK DLFFRVGYSR V YVPTTATA TTGDFSGSVT YGDARYDRKV GVANVRLAGS FSTTNTQLDS RPAGTRGAVG LIVRTDPLEN VPFRPQFNGQ VG YYTADNR VAAGNYNANA TKYGAGVVLN DFLLPQTKIG VRYDGYMAQN RQYTPFDGDG TQGYFSDANN NRRTNLNGVY VEG AYQDLI FSYGTYTLSQ KDLNGVEYGS GINNGQPARG QTFKISYKVN F |
-分子 #2: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 2 / コピー数: 18 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4.45 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: Buffer solutions were prepared fresh from sterile filtered concentrated stocksolutions. Solutions were filtered through a 0.22 um filter to avoid microbial contamination and degassed using a ...詳細: Buffer solutions were prepared fresh from sterile filtered concentrated stocksolutions. Solutions were filtered through a 0.22 um filter to avoid microbial contamination and degassed using a vacuum fold pump. The pH of the HEPES stock solution was adjusted with sodium hydroxide at 4 deg C. | ||||||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER/RHODIUM / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR / 詳細: 20 seconds, 15 mA | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 283.15 K / 装置: FEI VITROBOT MARK IV 詳細: Vitrobot options: Blot time 4.5 seconds, Blot force -10,1, Wait time 10 seconds, Drain time 0.5 seconds. | ||||||||||||
| 詳細 | Purified SlpA protein after size-exclusion chromatography |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 温度 | 最低: 70.0 K / 最高: 70.0 K |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 詳細 | EPU software with faster acquisition mode AFIS (Aberration Free Image Shift). |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 撮影したグリッド数: 1 / 実像数: 2294 / 平均露光時間: 4.8 sec. / 平均電子線量: 47.909 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 最大 デフォーカス(補正後): 4.0 µm / 最小 デフォーカス(補正後): 1.0 µm / 倍率(補正後): 81000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL / 温度因子: 51.67 / 当てはまり具合の基準: Best Fit |
|---|---|
| 得られたモデル |  PDB-8ae1: |
 ムービー
ムービー コントローラー
コントローラー




 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)