+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Vairimorpha necatrix 20S proteasome from spores | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Peptidase Activity / Reductive Evolution / Bound Peptide / Microsporidia / HYDROLASE | |||||||||
| 生物種 |  Vairimorpha necatrix (菌類) Vairimorpha necatrix (菌類) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.77 Å | |||||||||
 データ登録者 データ登録者 | Jespersen N / Ehrenbolger K / Winiger R / Svedberg D / Vossbrinck CR / Barandun J | |||||||||
| 資金援助 |  スウェーデン, European Union, 2件 スウェーデン, European Union, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structure of the reduced microsporidian proteasome bound by PI31-like peptides in dormant spores. 著者: Nathan Jespersen / Kai Ehrenbolger / Rahel R Winiger / Dennis Svedberg / Charles R Vossbrinck / Jonas Barandun /   要旨: Proteasomes play an essential role in the life cycle of intracellular pathogens with extracellular stages by ensuring proteostasis in environments with limited resources. In microsporidia, divergent ...Proteasomes play an essential role in the life cycle of intracellular pathogens with extracellular stages by ensuring proteostasis in environments with limited resources. In microsporidia, divergent parasites with extraordinarily streamlined genomes, the proteasome complexity and structure are unknown, which limits our understanding of how these unique pathogens adapt and compact essential eukaryotic complexes. We present cryo-electron microscopy structures of the microsporidian 20S and 26S proteasome isolated from dormant or germinated Vairimorpha necatrix spores. The discovery of PI31-like peptides, known to inhibit proteasome activity, bound simultaneously to all six active sites within the central cavity of the dormant spore proteasome, suggests reduced activity in the environmental stage. In contrast, the absence of the PI31-like peptides and the existence of 26S particles post-germination in the presence of ATP indicates that proteasomes are reactivated in nutrient-rich conditions. Structural and phylogenetic analyses reveal that microsporidian proteasomes have undergone extensive reductive evolution, lost at least two regulatory proteins, and compacted nearly every subunit. The highly derived structure of the microsporidian proteasome, and the minimized version of PI31 presented here, reinforce the feasibility of the development of specific inhibitors and provide insight into the unique evolution and biology of these medically and economically important pathogens. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15365.map.gz emd_15365.map.gz | 230.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15365-v30.xml emd-15365-v30.xml emd-15365.xml emd-15365.xml | 33.9 KB 33.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15365_fsc.xml emd_15365_fsc.xml | 13.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15365.png emd_15365.png | 187.3 KB | ||
| Filedesc metadata |  emd-15365.cif.gz emd-15365.cif.gz | 8.2 KB | ||
| その他 |  emd_15365_half_map_1.map.gz emd_15365_half_map_1.map.gz emd_15365_half_map_2.map.gz emd_15365_half_map_2.map.gz | 226 MB 226 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15365 http://ftp.pdbj.org/pub/emdb/structures/EMD-15365 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15365 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15365 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15365_validation.pdf.gz emd_15365_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15365_full_validation.pdf.gz emd_15365_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_15365_validation.xml.gz emd_15365_validation.xml.gz | 22.3 KB | 表示 | |
| CIF形式データ |  emd_15365_validation.cif.gz emd_15365_validation.cif.gz | 28.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15365 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15365 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15365 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15365 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15365.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15365.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.042 Å | ||||||||||||||||||||||||||||||||||||
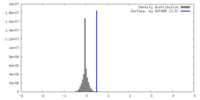
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_15365_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
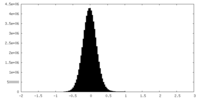
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_15365_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : 20S proteasome
+超分子 #1: 20S proteasome
+分子 #1: Proteasome Inhibitor 31-Like
+分子 #2: Proteasome subunit alpha type-2
+分子 #3: Proteasome subunit alpha type-3
+分子 #4: Proteasome subunit alpha type-4
+分子 #5: Proteasome subunit alpha type-5
+分子 #6: Proteasome subunit alpha type-6
+分子 #7: Proteasome subunit alpha type-7
+分子 #8: Proteasome subunit alpha type-1
+分子 #9: Proteasome subunit beta type-2
+分子 #10: Proteasome subunit beta type-3
+分子 #11: Proteasome subunit beta type-4
+分子 #12: Proteasome subunit beta type-5
+分子 #13: Proteasome subunit beta type-6
+分子 #14: Proteasome subunit beta type-7
+分子 #15: Proteasome subunit beta type-1
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 構成要素:
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 200 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 詳細: 15 mA | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | #0 - Image recording ID: 1 #0 - フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) #0 - 検出モード: COUNTING / #0 - 撮影したグリッド数: 1 / #0 - 平均露光時間: 5.0 sec. / #0 - 平均電子線量: 35.01 e/Å2 / #1 - Image recording ID: 2 #1 - フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) #1 - 検出モード: COUNTING / #1 - 撮影したグリッド数: 1 / #1 - 平均露光時間: 5.0 sec. / #1 - 平均電子線量: 36.334 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)