+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-0205 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the hydrazine dehydrogenase from Kuenia stuttgartiensis in the octameric state | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Candidatus Kuenenia stuttgartiensis (バクテリア) Candidatus Kuenenia stuttgartiensis (バクテリア) | |||||||||
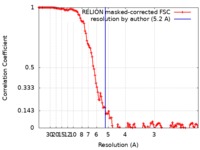
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.2 Å | |||||||||
 データ登録者 データ登録者 | Parey K / Barends TRM / Prinz S / Mohd A / Dietl A | |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2019 ジャーナル: Sci Adv / 年: 2019タイトル: A 192-heme electron transfer network in the hydrazine dehydrogenase complex. 著者: M Akram / A Dietl / U Mersdorf / S Prinz / W Maalcke / J Keltjens / C Ferousi / N M de Almeida / J Reimann / B Kartal / M S M Jetten / K Parey / T R M Barends /   要旨: Anaerobic ammonium oxidation (anammox) is a major process in the biogeochemical nitrogen cycle in which nitrite and ammonium are converted to dinitrogen gas and water through the highly reactive ...Anaerobic ammonium oxidation (anammox) is a major process in the biogeochemical nitrogen cycle in which nitrite and ammonium are converted to dinitrogen gas and water through the highly reactive intermediate hydrazine. So far, it is unknown how anammox organisms convert the toxic hydrazine into nitrogen and harvest the extremely low potential electrons (-750 mV) released in this process. We report the crystal structure and cryo electron microscopy structures of the responsible enzyme, hydrazine dehydrogenase, which is a 1.7 MDa multiprotein complex containing an extended electron transfer network of 192 heme groups spanning the entire complex. This unique molecular arrangement suggests a way in which the protein stores and releases the electrons obtained from hydrazine conversion, the final step in the globally important anammox process. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_0205.map.gz emd_0205.map.gz | 152.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-0205-v30.xml emd-0205-v30.xml emd-0205.xml emd-0205.xml | 12.4 KB 12.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_0205_fsc.xml emd_0205_fsc.xml | 12.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_0205.png emd_0205.png | 245.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-0205 http://ftp.pdbj.org/pub/emdb/structures/EMD-0205 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0205 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0205 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_0205_validation.pdf.gz emd_0205_validation.pdf.gz | 327.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_0205_full_validation.pdf.gz emd_0205_full_validation.pdf.gz | 326.7 KB | 表示 | |
| XML形式データ |  emd_0205_validation.xml.gz emd_0205_validation.xml.gz | 13 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0205 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0205 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0205 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0205 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_0205.map.gz / 形式: CCP4 / 大きさ: 163.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_0205.map.gz / 形式: CCP4 / 大きさ: 163.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.09 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Hydrazine dehydrogenase
| 全体 | 名称: Hydrazine dehydrogenase |
|---|---|
| 要素 |
|
-超分子 #1: Hydrazine dehydrogenase
| 超分子 | 名称: Hydrazine dehydrogenase / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Candidatus Kuenenia stuttgartiensis (バクテリア) Candidatus Kuenenia stuttgartiensis (バクテリア) |
| 分子量 | 理論値: 1.6 MDa |
-分子 #1: Hydrazine dehydrogenase
| 分子 | 名称: Hydrazine dehydrogenase / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO / EC番号: hydrazine dehydrogenase |
|---|---|
| 由来(天然) | 生物種:  Candidatus Kuenenia stuttgartiensis (バクテリア) Candidatus Kuenenia stuttgartiensis (バクテリア) |
| 配列 | 文字列: MRKFLKVTLA SALIGCGVIG TVSSLMVKEA KAVEIITHWV PHEVYGMPGE PDNSGKVFFS GLKAKYMGY PKDAQRSPYP GKYSKFWKTL PAYRYYIPDY MYNRDEVRPS NPIKGTFKLE Q CVACHSVM TPGIVRDYNK SAHSKAEPAP TGCDTCHGNN HQKLTMPSSK ...文字列: MRKFLKVTLA SALIGCGVIG TVSSLMVKEA KAVEIITHWV PHEVYGMPGE PDNSGKVFFS GLKAKYMGY PKDAQRSPYP GKYSKFWKTL PAYRYYIPDY MYNRDEVRPS NPIKGTFKLE Q CVACHSVM TPGIVRDYNK SAHSKAEPAP TGCDTCHGNN HQKLTMPSSK ACGTAECHET QY NEQGQGG IGSHASCSSF AQVECAWSIE RPPGDTAGCT FCHTSPEERC STCHQRHQFD PAV ARRSEQ CKTCHWGKDH RDWEAYDIGL HGTVYQVNKW DTEQFDFSKK LSDADYVGPT CQYC HMRGG HHNVQRASIV YTSMGMSMAD RGAPLWKEKR DRWVSICDDC HSPRFARENL QAMDE SVKD ASLKYRETFK VAEDLLIDGV LDPMPKDLCP DWSGQHIWSL KIGAYHDGEA YGGTTG ESG EFRMSNCTDV ERLCFESVGY FQTYIYKGMA HGSWNDATYS DGSFGMDRWL VNVKQNA SR ARRLAALEKK VGISWQPEQF WKTGEWLDQL TGPYIVKNHP GKTIFDLCPD PGWLDTHH A PAEEVEYIER KLKELGITAG SHSAHHHESG HDPAARSMKE H |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 / 構成要素 - 濃度: 25.0 mM / 構成要素 - 式: HEPES / 詳細: 25 mM HEPES/KOH, pH 7.5, 25 mM KCl |
|---|---|
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
| 詳細 | Glutaraldehyde cross-linked particles |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI POLARA 300 |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 452 / 平均露光時間: 8.0 sec. / 平均電子線量: 45.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 45872 / 照射モード: FLOOD BEAM / 撮影モード: OTHER / Cs: 2.0 mm / 最大 デフォーカス(公称値): -2.75 µm / 最小 デフォーカス(公称値): -0.75 µm / 倍率(公称値): 200000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)