+検索条件
-Structure paper
| タイトル | Small molecule inhibitors of 15-PGDH exploit a physiologic induced-fit closing system. |
|---|---|
| ジャーナル・号・ページ | Nat Commun, Vol. 14, Issue 1, Page 784, Year 2023 |
| 掲載日 | 2023年2月11日 |
 著者 著者 | Wei Huang / Hongyun Li / Janna Kiselar / Stephen P Fink / Sagar Regmi / Alexander Day / Yiyuan Yuan / Mark Chance / Joseph M Ready / Sanford D Markowitz / Derek J Taylor /  |
| PubMed 要旨 | 15-prostaglandin dehydrogenase (15-PGDH) is a negative regulator of tissue stem cells that acts via enzymatic activity of oxidizing and degrading PGE2, and related eicosanoids, that support stem ...15-prostaglandin dehydrogenase (15-PGDH) is a negative regulator of tissue stem cells that acts via enzymatic activity of oxidizing and degrading PGE2, and related eicosanoids, that support stem cells during tissue repair. Indeed, inhibiting 15-PGDH markedly accelerates tissue repair in multiple organs. Here we have used cryo-electron microscopy to solve the solution structure of native 15-PGDH and of 15-PGDH individually complexed with two distinct chemical inhibitors. These structures identify key 15-PGDH residues that mediate binding to both classes of inhibitors. Moreover, we identify a dynamic 15-PGDH lid domain that closes around the inhibitors, and that is likely fundamental to the physiologic 15-PGDH enzymatic mechanism. We furthermore identify two key residues, F185 and Y217, that act as hinges to regulate lid closing, and which both inhibitors exploit to capture the lid in the closed conformation, thus explaining their sub-nanomolar binding affinities. These findings provide the basis for further development of 15-PGDH targeted drugs as therapeutics for regenerative medicine. |
 リンク リンク |  Nat Commun / Nat Commun /  PubMed:36774348 / PubMed:36774348 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.4 - 3.3 Å |
| 構造データ | EMDB-27010: CRYO-EM STRUCTURE OF HUMAN 15-PGDH IN COMPLEX WITH SMALL MOLECULE SW209415 EMDB-27025: CRYO-EM STRUCTURE OF HUMAN 15-PGDH IN COMPLEX WITH SMALL MOLECULE SW222746 EMDB-29005, PDB-8fd8: |
| 化合物 | 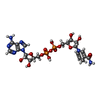 ChemComp-NAI: 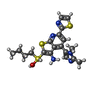 ChemComp-SWL: 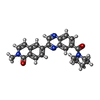 ChemComp-RLD: |
| 由来 |
|
 キーワード キーワード | OXIDOREDUCTASE / DEHYDROGENASE / INHIBITOR / OXIDOREDUCTASE-INHIBITOR complex |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について









 homo sapiens (ヒト)
homo sapiens (ヒト)