+検索条件
-Structure paper
| タイトル | Structural insights into caspase ADPR deacylization catalyzed by a bacterial effector and host calmodulin. |
|---|---|
| ジャーナル・号・ページ | Mol Cell, Vol. 82, Issue 24, Page 4712-44726.e7, Year 2022 |
| 掲載日 | 2022年12月15日 |
 著者 著者 | Kuo Zhang / Ting Peng / Xinyuan Tao / Miao Tian / Yanxin Li / Zhao Wang / Shuaifei Ma / Shufan Hu / Xing Pan / Juan Xue / Jiwei Luo / Qiulan Wu / Yang Fu / Shan Li /  |
| PubMed 要旨 | Programmed cell death and caspase proteins play a pivotal role in host innate immune response combating pathogen infections. Blocking cell death is employed by many bacterial pathogens as a universal ...Programmed cell death and caspase proteins play a pivotal role in host innate immune response combating pathogen infections. Blocking cell death is employed by many bacterial pathogens as a universal virulence strategy. CopC family type III effectors, including CopC from an environmental pathogen Chromobacterium violaceum, utilize calmodulin (CaM) as a co-factor to inactivate caspases by arginine ADPR deacylization. However, the molecular basis of the catalytic and substrate/co-factor binding mechanism is unknown. Here, we determine successive cryo-EM structures of CaM-CopC-caspase-3 ternary complex in pre-reaction, transition, and post-reaction states, which elucidate a multistep enzymatic mechanism of CopC-catalyzed ADPR deacylization. Moreover, we capture a snapshot of the detachment of modified caspase-3 from CopC. These structural insights are validated by mutagenesis analyses of CopC-mediated ADPR deacylization in vitro and animal infection in vivo. Our study offers a structural framework for understanding the molecular basis of arginine ADPR deacylization catalyzed by the CopC family. |
 リンク リンク |  Mol Cell / Mol Cell /  PubMed:36423631 PubMed:36423631 |
| 手法 | EM (単粒子) |
| 解像度 | 3.18 - 3.45 Å |
| 構造データ | EMDB-33310, PDB-7xn4: EMDB-33311, PDB-7xn5: EMDB-33312, PDB-7xn6: |
| 化合物 |  ChemComp-NAD: 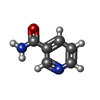 ChemComp-NCA: 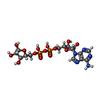 ChemComp-APR: |
| 由来 |
|
 キーワード キーワード | TOXIN / type III secretion system / Chromobacterium violaceum / caspase-3 / new PTM / programmed cell deathA / DP-ribosylation / ADPR-deacylization |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について









 homo sapiens (ヒト)
homo sapiens (ヒト) chromobacterium violaceum (バクテリア)
chromobacterium violaceum (バクテリア)