+検索条件
-Structure paper
| タイトル | Structural bases for aspartate recognition and polymerization efficiency of cyanobacterial cyanophycin synthetase. |
|---|---|
| ジャーナル・号・ページ | Nat Commun, Vol. 13, Issue 1, Page 5097, Year 2022 |
| 掲載日 | 2022年8月30日 |
 著者 著者 | Takuya Miyakawa / Jian Yang / Masato Kawasaki / Naruhiko Adachi / Ayumu Fujii / Yumiko Miyauchi / Tomonari Muramatsu / Toshio Moriya / Toshiya Senda / Masaru Tanokura /   |
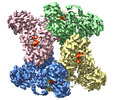
| PubMed 要旨 | Cyanophycin is a natural biopolymer consisting of equimolar amounts of aspartate and arginine as the backbone and branched sidechain, respectively. It is produced by a single enzyme, cyanophycin ...Cyanophycin is a natural biopolymer consisting of equimolar amounts of aspartate and arginine as the backbone and branched sidechain, respectively. It is produced by a single enzyme, cyanophycin synthetase (CphA1), and accumulates as a nitrogen reservoir during N fixation by most cyanobacteria. A recent structural study showed that three constituent domains of CphA1 function as two distinct catalytic sites and an oligomerization interface in cyanophycin synthesis. However, it remains unclear how the ATP-dependent addition of aspartate to cyanophycin is initiated at the catalytic site of the glutathione synthetase-like domain. Here, we report the cryogenic electron microscopy structures of CphA1, including a complex with aspartate, cyanophycin primer peptide, and ATP analog. These structures reveal the aspartate binding mode and phosphate-binding loop movement to the active site required for the reaction. Furthermore, structural and mutational data show a potential role of protein dynamics in the catalytic efficiency of the arginine condensation reaction. |
 リンク リンク |  Nat Commun / Nat Commun /  PubMed:36042318 / PubMed:36042318 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.52 - 2.96 Å |
| 構造データ | EMDB-32381, PDB-7wac: EMDB-32382, PDB-7wad: EMDB-32383, PDB-7wae: EMDB-32384, PDB-7waf: |
| 化合物 |  ChemComp-MG:  ChemComp-AGS:  ChemComp-ASP: 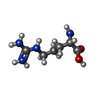 ChemComp-ARG: |
| 由来 |
|
 キーワード キーワード | LIGASE / Cyanophycin / Non-ribosomal peptide synthesis / ATP / Aspartate / Arginine |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について



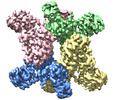

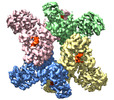

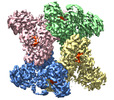


 trichodesmium erythraeum ims101 (バクテリア)
trichodesmium erythraeum ims101 (バクテリア)