+検索条件
-Structure paper
| タイトル | Cryo-EM structure of 50S ribosomal subunit bound with clarithromycin reveals dynamic and specific interactions with macrolides. |
|---|---|
| ジャーナル・号・ページ | Emerg Microbes Infect, Vol. 11, Issue 1, Page 293-305, Year 2022 |
| 掲載日 | 2022年2月14日 |
 著者 著者 | Wen Zhang / ZhiFei Li / Yufan Sun / Peng Cui / Jianhua Liang / Qinghe Xing / Jing Wu / Yanhui Xu / Wenhong Zhang / Ying Zhang / Lin He / Ning Gao /  |
| PubMed 要旨 | Tuberculosis (TB) is the leading infectious disease caused by (). Clarithromycin (CTY), an analog of erythromycin (ERY), is more potent against multidrug-resistance (MDR) TB. ERY and CTY were ...Tuberculosis (TB) is the leading infectious disease caused by (). Clarithromycin (CTY), an analog of erythromycin (ERY), is more potent against multidrug-resistance (MDR) TB. ERY and CTY were previously reported to bind to the nascent polypeptide exit tunnel (NPET) near peptidyl transferase center (PTC), but the only available CTY structure in complex with () ribosome could be misinterpreted due to resolution limitation. To date, the mechanism of specificity and efficacy of CTY for remains elusive since the ribosome-CTY complex structure is still unknown. Here, we employed new sample preparation methods and solved the ribosome-CTY complex structure at 3.3Å with cryo-EM technique, where the crucial gate site A2062 ( numbering) is located at the CTY binding site within NPET. Two alternative conformations of A2062, a novel -conformation as well as a swayed conformation bound with water molecule at interface, may play a role in coordinating the binding of specific drug molecules. The previously overlooked C-H hydrogen bond (H-bond) and π interaction may collectively contribute to the enhanced binding affinity. Together, our structure data provide a structural basis for the dynamic binding as well as the specificity of CTY and explain of how a single methyl group in CTY improves its potency, which provides new evidence to reveal previously unclear mechanism of translational modulation for future drug design and anti-TB therapy. Furthermore, our sample preparation method may facilitate drug discovery based on the complexes with low water solubility drugs by cryo-EM technique. |
 リンク リンク |  Emerg Microbes Infect / Emerg Microbes Infect /  PubMed:34935599 / PubMed:34935599 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.3 Å |
| 構造データ | EMDB-31398, PDB-7f0d: |
| 化合物 | 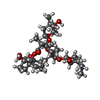 ChemComp-CTY:  ChemComp-MG:  ChemComp-HOH: |
| 由来 |
|
 キーワード キーワード | RIBOSOME / Mycobacterium tuberculosis;50S ribosomal subunit;gate site A2062;clarithromycin; dynamic interaction;Cryo-EM;drug resistance |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について





 mycobacterium tuberculosis h37ra (結核菌)
mycobacterium tuberculosis h37ra (結核菌)