+検索条件
-Structure paper
| タイトル | Structural basis for the allosteric inhibition of UMP kinase from Gram-positive bacteria, a promising antibacterial target. |
|---|---|
| ジャーナル・号・ページ | FEBS J, Vol. 289, Issue 16, Page 4869-4887, Year 2022 |
| 掲載日 | 2022年3月9日 |
 著者 著者 | Patrick Walter / Ariel Mechaly / Julien Bous / Ahmed Haouz / Patrick England / Joséphine Lai-Kee-Him / Aurélie Ancelin / Sylviane Hoos / Bruno Baron / Stefano Trapani / Patrick Bron / Gilles Labesse / Hélène Munier-Lehmann /  |
| PubMed 要旨 | Tuberculosis claims significantly more than one million lives each year. A feasible way to face the issue of drug resistance is the development of new antibiotics. Bacterial uridine 5'-monophosphate ...Tuberculosis claims significantly more than one million lives each year. A feasible way to face the issue of drug resistance is the development of new antibiotics. Bacterial uridine 5'-monophosphate (UMP) kinase is a promising target for novel antibiotic discovery as it is essential for bacterial survival and has no counterpart in human cells. The UMP kinase from M. tuberculosis is also a model of particular interest for allosteric regulation with two effectors, GTP (positive) and UTP (negative). In this study, using X-ray crystallography and cryo-electron microscopy, we report for the first time a detailed description of the negative effector UTP-binding site of a typical Gram-positive behaving UMP kinase. Comparison between this snapshot of low affinity for Mg-ATP with our previous 3D-structure of the GTP-bound complex of high affinity for Mg-ATP led to a better understanding of the cooperative mechanism and the allosteric regulation of UMP kinase. Thermal shift assay and circular dichroism experiments corroborate our model of an inhibition by UTP linked to higher flexibility of the Mg-ATP-binding domain. These new structural insights provide valuable knowledge for future drug discovery strategies targeting bacterial UMP kinases. |
 リンク リンク |  FEBS J / FEBS J /  PubMed:35152545 PubMed:35152545 |
| 手法 | EM (単粒子) / X線回折 |
| 解像度 | 2.85 - 3.33 Å |
| 構造データ | EMDB-12158, PDB-7bes:  PDB-7bix:  PDB-7bl7: |
| 化合物 | 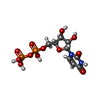 ChemComp-UDP: 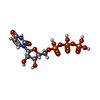 ChemComp-UTP:  ChemComp-HOH: |
| 由来 |
|
 キーワード キーワード |  TRANSFERASE (転移酵素) / TRANSFERASE (転移酵素) /  nucleotide metabolism (ヌクレオチド) / nucleotide metabolism (ヌクレオチド) /  UMP kinase / UMP kinase /  allosteric regulation (アロステリック効果) / antibacterial target allosteric regulation (アロステリック効果) / antibacterial target |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について






