+検索条件
-Structure paper
| タイトル | The structures and gating mechanism of human calcium homeostasis modulator 2. |
|---|---|
| ジャーナル・号・ページ | Nature, Vol. 576, Issue 7785, Page 163-167, Year 2019 |
| 掲載日 | 2019年11月27日 |
 著者 著者 | Wooyoung Choi / Nicolina Clemente / Weinan Sun / Juan Du / Wei Lü /  |
| PubMed 要旨 | Calcium homeostasis modulators (CALHMs) are voltage-gated, Ca-inhibited nonselective ion channels that act as major ATP release channels, and have important roles in gustatory signalling and neuronal ...Calcium homeostasis modulators (CALHMs) are voltage-gated, Ca-inhibited nonselective ion channels that act as major ATP release channels, and have important roles in gustatory signalling and neuronal toxicity. Dysfunction of CALHMs has previously been linked to neurological disorders. Here we present cryo-electron microscopy structures of the human CALHM2 channel in the Ca-free active or open state and in the ruthenium red (RUR)-bound inhibited state, at resolutions up to 2.7 Å. Our work shows that purified CALHM2 channels form both gap junctions and undecameric hemichannels. The protomer shows a mirrored arrangement of the transmembrane domains (helices S1-S4) relative to other channels with a similar topology, such as connexins, innexins and volume-regulated anion channels. Upon binding to RUR, we observed a contracted pore with notable conformational changes of the pore-lining helix S1, which swings nearly 60° towards the pore axis from a vertical to a lifted position. We propose a two-section gating mechanism in which the S1 helix coarsely adjusts, and the N-terminal helix fine-tunes, the pore size. We identified a RUR-binding site near helix S1 that may stabilize this helix in the lifted conformation, giving rise to channel inhibition. Our work elaborates on the principles of CALHM2 channel architecture and symmetry, and the mechanism that underlies channel inhibition. |
 リンク リンク |  Nature / Nature /  PubMed:31776515 / PubMed:31776515 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.7 - 3.5 Å |
| 構造データ | EMDB-20788, PDB-6uiv: EMDB-20789, PDB-6uiw: EMDB-20790, PDB-6uix: |
| 化合物 | 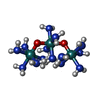 ChemComp-R2R: |
| 由来 |
|
 キーワード キーワード |  TRANSPORT PROTEIN (運搬体タンパク質) / calcium homeostasis modulator / CALHM2 / TRANSPORT PROTEIN/INHIBITOR / TRANSPORT PROTEIN (運搬体タンパク質) / calcium homeostasis modulator / CALHM2 / TRANSPORT PROTEIN/INHIBITOR /  ruthenium red / TRANSPORT PROTEIN-INHIBITOR complex / ruthenium red / TRANSPORT PROTEIN-INHIBITOR complex /  gap junction (ギャップ結合) gap junction (ギャップ結合) |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について










