+検索条件
-Structure paper
| タイトル | The thermodynamic signature of ligand binding to histone deacetylase-like amidohydrolases is most sensitive to the flexibility in the L2-loop lining the active site pocket. |
|---|---|
| ジャーナル・号・ページ | Biochim. Biophys. Acta, Vol. 1861, Page 1855-1863, Year 2017 |
| 掲載日 | 2016年3月23日 (構造データの登録日) |
 著者 著者 | Meyners, C. / Kramer, A. / Yildiz, O. / Meyer-Almes, F.J. |
 リンク リンク |  Biochim. Biophys. Acta / Biochim. Biophys. Acta /  PubMed:28389333 PubMed:28389333 |
| 手法 | X線回折 |
| 解像度 | 1.42 - 1.7 Å |
| 構造データ |  PDB-5g17:  PDB-5g1a:  PDB-5g1b: |
| 化合物 |  ChemComp-ZN:  ChemComp-K: 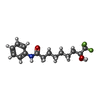 ChemComp-6DK:  ChemComp-HOH: 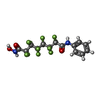 ChemComp-7H1:  ChemComp-1PE:  ChemComp-PEG: |
| 由来 |
|
 キーワード キーワード | HYDROLASE / HDAH / HDAC / HDLP |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について



 alcaligenes (バクテリア)
alcaligenes (バクテリア)