+検索条件
-Structure paper
| タイトル | Placing steroid hormones within the human ABCC3 transporter reveals a compatible amphiphilic substrate-binding pocket. |
|---|---|
| ジャーナル・号・ページ | EMBO J, Vol. 42, Issue 17, Page e113415, Year 2023 |
| 掲載日 | 2023年9月4日 |
 著者 著者 | Jie Wang / Xu Li / Fang-Fang Wang / Meng-Ting Cheng / Yao-Xu Mao / Shu-Cheng Fang / Liang Wang / Cong-Zhao Zhou / Wen-Tao Hou / Yuxing Chen /  |
| PubMed 要旨 | The human ABC transporter ABCC3 (also known as MRP3) transports a wide spectrum of substrates, including endogenous metabolites and exogenous drugs. Accordingly, it participates in multiple ...The human ABC transporter ABCC3 (also known as MRP3) transports a wide spectrum of substrates, including endogenous metabolites and exogenous drugs. Accordingly, it participates in multiple physiological processes and is involved in diverse human diseases such as intrahepatic cholestasis of pregnancy, which is caused by the intracellular accumulation of bile acids and estrogens. Here, we report three cryogenic electron microscopy structures of ABCC3: in the apo-form and in complexed forms bound to either the conjugated sex hormones β-estradiol 17-(β-D-glucuronide) and dehydroepiandrosterone sulfate. For both hormones, the steroid nuclei that superimpose against each other occupy the hydrophobic center of the transport cavity, whereas the two conjugation groups are separated and fixed by the hydrophilic patches in two transmembrane domains. Structural analysis combined with site-directed mutagenesis and ATPase activity assays revealed that ABCC3 possesses an amphiphilic substrate-binding pocket able to hold either conjugated hormone in an asymmetric pattern. These data build on consensus features of the substrate-binding pocket of MRPs and provide a structural platform for the rational design of inhibitors. |
 リンク リンク |  EMBO J / EMBO J /  PubMed:37485728 / PubMed:37485728 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.07 - 3.65 Å |
| 構造データ | EMDB-35043, PDB-8hvh: EMDB-35049, PDB-8hw2: EMDB-35050, PDB-8hw4: |
| 化合物 | 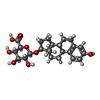 ChemComp-U38: 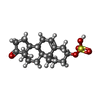 ChemComp-ZWY: |
| 由来 |
|
 キーワード キーワード | MEMBRANE PROTEIN / ABC transporter / TRANSPORT PROTEIN / multidrug resistance protein |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について






 homo sapiens (ヒト)
homo sapiens (ヒト)