+検索条件
-Structure paper
| タイトル | Non-canonical substrate recognition by the human WDR26-CTLH E3 ligase regulates prodrug metabolism. |
|---|---|
| ジャーナル・号・ページ | Mol Cell, Vol. 84, Issue 10, Page 1948-1963.e11, Year 2024 |
| 掲載日 | 2024年5月16日 |
 著者 著者 | Karthik V Gottemukkala / Jakub Chrustowicz / Dawafuti Sherpa / Sara Sepic / Duc Tung Vu / Özge Karayel / Eleftheria C Papadopoulou / Annette Gross / Kenji Schorpp / Susanne von Gronau / Kamyar Hadian / Peter J Murray / Matthias Mann / Brenda A Schulman / Arno F Alpi /  |
| PubMed 要旨 | The yeast glucose-induced degradation-deficient (GID) E3 ubiquitin ligase forms a suite of complexes with interchangeable receptors that selectively recruit N-terminal degron motifs of metabolic ...The yeast glucose-induced degradation-deficient (GID) E3 ubiquitin ligase forms a suite of complexes with interchangeable receptors that selectively recruit N-terminal degron motifs of metabolic enzyme substrates. The orthologous higher eukaryotic C-terminal to LisH (CTLH) E3 complex has been proposed to also recognize substrates through an alternative subunit, WDR26, which promotes the formation of supramolecular CTLH E3 assemblies. Here, we discover that human WDR26 binds the metabolic enzyme nicotinamide/nicotinic-acid-mononucleotide-adenylyltransferase 1 (NMNAT1) and mediates its CTLH E3-dependent ubiquitylation independently of canonical GID/CTLH E3-family substrate receptors. The CTLH subunit YPEL5 inhibits NMNAT1 ubiquitylation and cellular turnover by WDR26-CTLH E3, thereby affecting NMNAT1-mediated metabolic activation and cytotoxicity of the prodrug tiazofurin. Cryoelectron microscopy (cryo-EM) structures of NMNAT1- and YPEL5-bound WDR26-CTLH E3 complexes reveal an internal basic degron motif of NMNAT1 essential for targeting by WDR26-CTLH E3 and degron mimicry by YPEL5's N terminus antagonizing substrate binding. Thus, our data provide a mechanistic understanding of how YPEL5-WDR26-CTLH E3 acts as a modulator of NMNAT1-dependent metabolism. |
 リンク リンク |  Mol Cell / Mol Cell /  PubMed:38759627 / PubMed:38759627 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.2 - 13.9 Å |
| 構造データ |  EMDB-18170: YPEL5-bound WDR26-CTLH E3 ligase - assembly I  EMDB-18171: YPEL5-bound WDR26-CTLH E3 ligase - assembly II  EMDB-18172: NMNAT1 core-bound RANBP9-TWA1-WDR26 module of WDR26-CTLH E3 ligase  EMDB-18173: NMNAT1 loop-bound RANBP9-TWA1-WDR26 module of WDR26-CTLH E3 ligase  EMDB-18174: NMNAT1-bound WDR26-CTLH E3 ligase assembly I - class 1  EMDB-18175: NMNAT1-bound WDR26-CTLH E3 ligase assembly I - class 2  EMDB-18176: NMNAT1-bound WDR26-CTLH E3 ligase assembly II - class 1  EMDB-18177: NMNAT1-bound WDR26-CTLH E3 ligase assembly II - class 2  EMDB-18178: NMNAT1-bound WDR26-CTLH E3 ligase assembly II - class 3 EMDB-18316, PDB-8qbn: EMDB-18345, PDB-8qe8: |
| 化合物 |  ChemComp-ZN: 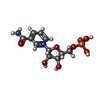 ChemComp-NMN: |
| 由来 |
|
 キーワード キーワード | LIGASE / E3 ubiquitin ligase / CTLH / GID / NMNAT1 / YPEL5 / NAD / NADH |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について







 homo sapiens (ヒト)
homo sapiens (ヒト)