+検索条件
-Structure paper
| タイトル | Complexes of poliovirus serotypes with their common cellular receptor, CD155. |
|---|---|
| ジャーナル・号・ページ | J Virol, Vol. 77, Issue 8, Page 4827-4835, Year 2003 |
| 掲載日 | 2003年5月5日 |
 著者 著者 | Yongning He / Steffen Mueller / Paul R Chipman / Carol M Bator / Xiaozhong Peng / Valorie D Bowman / Suchetana Mukhopadhyay / Eckard Wimmer / Richard J Kuhn / Michael G Rossmann /  |
| PubMed 要旨 | Structures of all three poliovirus (PV) serotypes (PV1, PV2, and PV3) complexed with their cellular receptor, PV receptor (PVR or CD155), were determined by cryoelectron microscopy. Both glycosylated ...Structures of all three poliovirus (PV) serotypes (PV1, PV2, and PV3) complexed with their cellular receptor, PV receptor (PVR or CD155), were determined by cryoelectron microscopy. Both glycosylated and fully deglycosylated CD155 exhibited similar binding sites and orientations in the viral canyon for all three PV serotypes, showing that all three serotypes use a common mechanism for cell entry. Difference maps between the glycosylated and deglycosylated CD155 complexes determined the sites of the carbohydrate moieties that, in turn, helped to verify the position of the receptor relative to the viral surface. The proximity of the CD155 carbohydrate site at Asn105 to the viral surface in the receptor-virus complex suggests that it might interfere with receptor docking, an observation consistent with the properties of mutant CD155. The footprints of CD155 on PV surfaces indicate that the south rim of the canyon dominates the virus-receptor interactions and may correspond to the initial CD155 binding state of the receptor-mediated viral uncoating. In contrast, the interaction of CD155 with the north rim of the canyon, especially the region immediately outside the viral hydrophobic pocket that normally binds a cellular "pocket factor," may be critical for the release of the pocket factor, decreasing the virus stability and hence initiating uncoating. The large area of the CD155 footprint on the PV surface, in comparison with other picornavirus-receptor interactions, could be a potential limitation on the viability of PV escape mutants from antibody neutralization. Many of these are likely to have lost their ability to bind CD155, resulting in there being only three PV serotypes. |
 リンク リンク |  J Virol / J Virol /  PubMed:12663789 / PubMed:12663789 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 15 Å |
| 構造データ |  PDB-1nn8: |
| 化合物 | 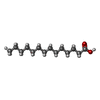 ChemComp-MYR: |
| 由来 |
|
 キーワード キーワード | Virus/Receptor / icosahedral virus / picornavirus / Virus-Receptor COMPLEX |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について



 homo sapiens (ヒト)
homo sapiens (ヒト)
 human poliovirus 1 mahoney (ポリオウイルス)
human poliovirus 1 mahoney (ポリオウイルス)