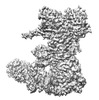
登録情報 データベース : EMDB / ID : EMD-33537タイトル Hsp90-AhR-p23 complex Hsp90-AhR-p23 complex 複合体 : Hsp90-AhR-p23 complex複合体 : Heat shock protein HSP 90-betaタンパク質・ペプチド : Heat shock protein HSP 90-beta複合体 : Prostaglandin E synthase 3タンパク質・ペプチド : Prostaglandin E synthase 3複合体 : Aryl hydrocarbon receptorタンパク質・ペプチド : Aryl hydrocarbon receptorリガンド : ADENOSINE-5'-DIPHOSPHATEリガンド : BERYLLIUM TRIFLUORIDE ION / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
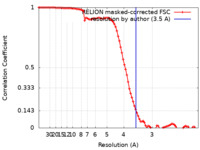
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Mus musculus (ハツカネズミ)手法 / / 解像度 : 3.5 Å Wen ZL / Zhai YJ / Zhu Y / Sun F 資金援助 1件 Organization Grant number 国 Not funded
ジャーナル : Structure / 年 : 2023タイトル : Cryo-EM structure of the cytosolic AhR complex.著者 : Zuoling Wen / Yuebin Zhang / Beirong Zhang / Yumo Hang / Li Xu / Yangsheng Chen / Qunhui Xie / Qun Zhao / Lihua Zhang / Guohui Li / Bin Zhao / Fei Sun / Yujia Zhai / Yun Zhu / 要旨 : Aryl hydrocarbon receptor (AhR) is an important ligand-activated transcription factor involved in the regulation of various important physiological functions. Here, we report the cryo-EM structures ... Aryl hydrocarbon receptor (AhR) is an important ligand-activated transcription factor involved in the regulation of various important physiological functions. Here, we report the cryo-EM structures of the Hsp90-AhR-p23 complex with or without bound XAP2, where the structure of the mouse AhR PAS-B domain is resolved. A highly conserved bridge motif of AhR is responsible for the interaction with the Hsp90 dimeric lumen. The ligand-free AhR PAS-B domain is attached to the Hsp90 dimer and is stabilized in the complex with bound XAP2. In addition, the DE-loop and a group of conserved pocket inner residues in the AhR PAS-B domain are found to be important for ligand binding. These results reveal the structural basis of the biological functions of AhR. Moreover, the protein purification method presented here allows the isolation of stable mouse AhR protein, which could be used to develop high-sensitivity biosensors for environmental pollutant detection. 履歴 登録 2022年6月3日 - ヘッダ(付随情報) 公開 2023年1月4日 - マップ公開 2023年1月4日 - 更新 2024年7月3日 - 現状 2024年7月3日 処理サイト : PDBj / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 2023
ジャーナル: Structure / 年: 2023
 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_33537.map.gz
emd_33537.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-33537-v30.xml
emd-33537-v30.xml emd-33537.xml
emd-33537.xml EMDBヘッダ
EMDBヘッダ emd_33537_fsc.xml
emd_33537_fsc.xml FSCデータファイル
FSCデータファイル emd_33537.png
emd_33537.png emd-33537.cif.gz
emd-33537.cif.gz emd_33537_half_map_1.map.gz
emd_33537_half_map_1.map.gz emd_33537_half_map_2.map.gz
emd_33537_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-33537
http://ftp.pdbj.org/pub/emdb/structures/EMD-33537 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33537
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33537 emd_33537_validation.pdf.gz
emd_33537_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_33537_full_validation.pdf.gz
emd_33537_full_validation.pdf.gz emd_33537_validation.xml.gz
emd_33537_validation.xml.gz emd_33537_validation.cif.gz
emd_33537_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33537
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33537 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33537
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33537

 F&H 検索
F&H 検索 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_33537.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_33537.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素










 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー


























 Z
Z Y
Y X
X