+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-1369 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Progression of the ribosome recycling factor through the ribosome dissociates the two ribosomal subunits. | |||||||||
 マップデータ マップデータ | 50S-RRF-UG Complex | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |   Escherichia coli (大腸菌) Escherichia coli (大腸菌) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 18.4 Å クライオ電子顕微鏡法 / 解像度: 18.4 Å | |||||||||
 データ登録者 データ登録者 | Barat C / Datta PP / Raj VS / Sharma MR / Kaji H / Kaji A / Agrawal RK | |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2007 ジャーナル: Mol Cell / 年: 2007タイトル: Progression of the ribosome recycling factor through the ribosome dissociates the two ribosomal subunits. 著者: Chandana Barat / Partha P Datta / V Samuel Raj / Manjuli R Sharma / Hideko Kaji / Akira Kaji / Rajendra K Agrawal /  要旨: After the termination step of translation, the posttermination complex (PoTC), composed of the ribosome, mRNA, and a deacylated tRNA, is processed by the concerted action of the ribosome-recycling ...After the termination step of translation, the posttermination complex (PoTC), composed of the ribosome, mRNA, and a deacylated tRNA, is processed by the concerted action of the ribosome-recycling factor (RRF), elongation factor G (EF-G), and GTP to prepare the ribosome for a fresh round of protein synthesis. However, the sequential steps of dissociation of the ribosomal subunits, and release of mRNA and deacylated tRNA from the PoTC, are unclear. Using three-dimensional cryo-electron microscopy, in conjunction with undecagold-labeled RRF, we show that RRF is capable of spontaneously moving from its initial binding site on the 70S Escherichia coli ribosome to a site exclusively on the large 50S ribosomal subunit. This movement leads to disruption of crucial intersubunit bridges and thereby to the dissociation of the two ribosomal subunits, the central event in ribosome recycling. Results of this study allow us to propose a model of ribosome recycling. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_1369.map.gz emd_1369.map.gz | 7.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-1369-v30.xml emd-1369-v30.xml emd-1369.xml emd-1369.xml | 9.9 KB 9.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  1369.gif 1369.gif | 20.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-1369 http://ftp.pdbj.org/pub/emdb/structures/EMD-1369 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1369 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1369 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_1369.map.gz / 形式: CCP4 / 大きさ: 8.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_1369.map.gz / 形式: CCP4 / 大きさ: 8.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 50S-RRF-UG Complex | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.76 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
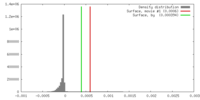
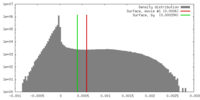
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Binding position of RRF on the 50S subunit, after RRF dependent 7...
| 全体 | 名称: Binding position of RRF on the 50S subunit, after RRF dependent 70S dissociation |
|---|---|
| 要素 |
|
-超分子 #1000: Binding position of RRF on the 50S subunit, after RRF dependent 7...
| 超分子 | 名称: Binding position of RRF on the 50S subunit, after RRF dependent 70S dissociation タイプ: sample / ID: 1000 / Number unique components: 2 |
|---|---|
| 分子量 | 理論値: 1.5205 MDa |
-超分子 #1: 50S Large Subunit of Escherichia coli ribosome
| 超分子 | 名称: 50S Large Subunit of Escherichia coli ribosome / タイプ: complex / ID: 1 / 組換発現: No / Ribosome-details: ribosome-prokaryote: LSU 50S |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 分子量 | 実験値: 1.5 MDa |
-分子 #1: Ribosome Recycling Factor
| 分子 | 名称: Ribosome Recycling Factor / タイプ: protein_or_peptide / ID: 1 / 組換発現: No |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 分子量 | 実験値: 20.5 KDa |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 詳細: 8.2mM MgSO4, 80mM NH4Cl, 10mM Tris (pH 7.4), without DTT |
|---|---|
| グリッド | 詳細: Quantifoil 300 mesh Cu grids |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: HOMEMADE PLUNGER 詳細: Vitrification instrument: Wadsworth Centers fabricated guillotine plunger 手法: 5ul of specimen was applied to the grid, then blotted using Whatman number 1 filter paper for 2 to 4 seconds, then plunged. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 50760 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 0.7 µm / 倍率(公称値): 50000 Bright-field microscopy / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 0.7 µm / 倍率(公称値): 50000 |
| 試料ステージ | 試料ホルダー: Oxford Cryo-transfer holder / 試料ホルダーモデル: OTHER |
| 温度 | 平均: 93 K |
| アライメント法 | Legacy - 非点収差: objective lens astigmatism corrected at 210,000X magnification. |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM / デジタル化 - スキャナー: ZEISS SCAI / デジタル化 - サンプリング間隔: 14 µm / 実像数: 109 / 平均電子線量: 20 e/Å2 / ビット/ピクセル: 12 |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 18.4 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: SPIDER / 使用した粒子像数: 5708 |
|---|
-原子モデル構築 1
| ソフトウェア | 名称: O |
|---|---|
| 詳細 | Protocol: Rigid Body |
| 精密化 | プロトコル: RIGID BODY FIT |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)