+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8qmo | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the benzo[a]pyrene-bound Hsp90-XAP2-AHR complex | |||||||||||||||
 要素 要素 |
| |||||||||||||||
 キーワード キーワード |  TRANSCRIPTION (転写 (生物学)) / TRANSCRIPTION (転写 (生物学)) /  detoxification / chemical pollutants / exposome detoxification / chemical pollutants / exposome | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 GAF domain binding / negative regulation of T cell mediated immune response to tumor cell / cytosolic aryl hydrocarbon receptor complex / regulation of B cell proliferation / cellular response to molecule of bacterial origin / GAF domain binding / negative regulation of T cell mediated immune response to tumor cell / cytosolic aryl hydrocarbon receptor complex / regulation of B cell proliferation / cellular response to molecule of bacterial origin /  regulation of adaptive immune response / regulation of adaptive immune response /  : / cellular response to 2,3,7,8-tetrachlorodibenzodioxine / nuclear aryl hydrocarbon receptor complex / HSP90-CDC37 chaperone complex ... : / cellular response to 2,3,7,8-tetrachlorodibenzodioxine / nuclear aryl hydrocarbon receptor complex / HSP90-CDC37 chaperone complex ... GAF domain binding / negative regulation of T cell mediated immune response to tumor cell / cytosolic aryl hydrocarbon receptor complex / regulation of B cell proliferation / cellular response to molecule of bacterial origin / GAF domain binding / negative regulation of T cell mediated immune response to tumor cell / cytosolic aryl hydrocarbon receptor complex / regulation of B cell proliferation / cellular response to molecule of bacterial origin /  regulation of adaptive immune response / regulation of adaptive immune response /  : / cellular response to 2,3,7,8-tetrachlorodibenzodioxine / nuclear aryl hydrocarbon receptor complex / HSP90-CDC37 chaperone complex / positive regulation of cyclin-dependent protein kinase activity / negative regulation of proteasomal protein catabolic process / Aryl hydrocarbon receptor signalling / : / cellular response to 2,3,7,8-tetrachlorodibenzodioxine / nuclear aryl hydrocarbon receptor complex / HSP90-CDC37 chaperone complex / positive regulation of cyclin-dependent protein kinase activity / negative regulation of proteasomal protein catabolic process / Aryl hydrocarbon receptor signalling /  aryl hydrocarbon receptor complex / dynein axonemal particle / aryl hydrocarbon receptor complex / dynein axonemal particle /  histone methyltransferase binding / regulation of protein kinase A signaling / protein kinase regulator activity / protein targeting to mitochondrion / positive regulation of protein localization to cell surface / histone methyltransferase binding / regulation of protein kinase A signaling / protein kinase regulator activity / protein targeting to mitochondrion / positive regulation of protein localization to cell surface /  生体異物 / ATP-dependent protein binding / Phase I - Functionalization of compounds / protein maturation by protein folding / negative regulation of protein metabolic process / positive regulation of tau-protein kinase activity / 生体異物 / ATP-dependent protein binding / Phase I - Functionalization of compounds / protein maturation by protein folding / negative regulation of protein metabolic process / positive regulation of tau-protein kinase activity /  telomerase holoenzyme complex assembly / Uptake and function of diphtheria toxin / blood vessel development / TPR domain binding / telomerase holoenzyme complex assembly / Uptake and function of diphtheria toxin / blood vessel development / TPR domain binding /  E-box binding / positive regulation of transforming growth factor beta receptor signaling pathway / dendritic growth cone / positive regulation of phosphoprotein phosphatase activity / TFIID-class transcription factor complex binding / E-box binding / positive regulation of transforming growth factor beta receptor signaling pathway / dendritic growth cone / positive regulation of phosphoprotein phosphatase activity / TFIID-class transcription factor complex binding /  aryl hydrocarbon receptor binding / cAMP-mediated signaling / Sema3A PAK dependent Axon repulsion / The NLRP3 inflammasome / regulation of protein ubiquitination / HSF1-dependent transactivation / telomere maintenance via telomerase / negative regulation of proteasomal ubiquitin-dependent protein catabolic process / response to unfolded protein / HSF1 activation / chaperone-mediated protein complex assembly / Attenuation phase / Endogenous sterols / RHOBTB2 GTPase cycle / cis-regulatory region sequence-specific DNA binding / aryl hydrocarbon receptor binding / cAMP-mediated signaling / Sema3A PAK dependent Axon repulsion / The NLRP3 inflammasome / regulation of protein ubiquitination / HSF1-dependent transactivation / telomere maintenance via telomerase / negative regulation of proteasomal ubiquitin-dependent protein catabolic process / response to unfolded protein / HSF1 activation / chaperone-mediated protein complex assembly / Attenuation phase / Endogenous sterols / RHOBTB2 GTPase cycle / cis-regulatory region sequence-specific DNA binding /  Purinergic signaling in leishmaniasis infection / supramolecular fiber organization / Purinergic signaling in leishmaniasis infection / supramolecular fiber organization /  DNA polymerase binding / axonal growth cone / cellular response to cAMP / cellular response to forskolin / positive regulation of telomerase activity / DNA polymerase binding / axonal growth cone / cellular response to cAMP / cellular response to forskolin / positive regulation of telomerase activity /  heat shock protein binding / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / TBP-class protein binding / cellular response to interleukin-4 / Gene and protein expression by JAK-STAT signaling after Interleukin-12 stimulation / xenobiotic metabolic process / nitric-oxide synthase regulator activity / ESR-mediated signaling / placenta development / heat shock protein binding / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / TBP-class protein binding / cellular response to interleukin-4 / Gene and protein expression by JAK-STAT signaling after Interleukin-12 stimulation / xenobiotic metabolic process / nitric-oxide synthase regulator activity / ESR-mediated signaling / placenta development /  peptidyl-prolyl cis-trans isomerase activity / positive regulation of cell differentiation / ATP-dependent protein folding chaperone / peptidyl-prolyl cis-trans isomerase activity / positive regulation of cell differentiation / ATP-dependent protein folding chaperone /  peptide binding / peptide binding /  Hsp90 protein binding / circadian regulation of gene expression / DDX58/IFIH1-mediated induction of interferon-alpha/beta / tau protein binding / Hsp90 protein binding / circadian regulation of gene expression / DDX58/IFIH1-mediated induction of interferon-alpha/beta / tau protein binding /  transcription coactivator binding / PPARA activates gene expression / response to toxic substance / Regulation of actin dynamics for phagocytic cup formation / transcription coactivator binding / PPARA activates gene expression / response to toxic substance / Regulation of actin dynamics for phagocytic cup formation /  kinase binding / negative regulation of inflammatory response / Chaperone Mediated Autophagy / kinase binding / negative regulation of inflammatory response / Chaperone Mediated Autophagy /  histone deacetylase binding / The role of GTSE1 in G2/M progression after G2 checkpoint / histone deacetylase binding / The role of GTSE1 in G2/M progression after G2 checkpoint /  nuclear receptor activity / nuclear receptor activity /  regulation of protein localization / positive regulation of nitric oxide biosynthetic process / disordered domain specific binding / unfolded protein binding / regulation of protein localization / positive regulation of nitric oxide biosynthetic process / disordered domain specific binding / unfolded protein binding /  メラノソーム / sequence-specific double-stranded DNA binding / メラノソーム / sequence-specific double-stranded DNA binding /  フォールディング / フォールディング /  double-stranded RNA binding / MHC class II protein complex binding / cellular response to heat / double-stranded RNA binding / MHC class II protein complex binding / cellular response to heat /  遺伝子発現の調節 / secretory granule lumen / Estrogen-dependent gene expression / ficolin-1-rich granule lumen / 遺伝子発現の調節 / secretory granule lumen / Estrogen-dependent gene expression / ficolin-1-rich granule lumen /  transcription regulator complex / RNA polymerase II-specific DNA-binding transcription factor binding transcription regulator complex / RNA polymerase II-specific DNA-binding transcription factor binding類似検索 - 分子機能 | |||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.76 Å クライオ電子顕微鏡法 / 解像度: 2.76 Å | |||||||||||||||
 データ登録者 データ登録者 | Kwong, H.S. / Grandvuillemin, L. / Sirounian, S. / Ancelin, A. / Lai-Kee-Him, J. / Carivenc, C. / Lancey, C. / Ragan, T.J. / Hesketh, E.L. / Bourguet, W. / Gruszczyk, J. | |||||||||||||||
| 資金援助 |  フランス, 4件 フランス, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: J Mol Biol / 年: 2024 ジャーナル: J Mol Biol / 年: 2024タイトル: Structural Insights into the Activation of Human Aryl Hydrocarbon Receptor by the Environmental Contaminant Benzo[a]pyrene and Structurally Related Compounds. 著者: Hok-Sau Kwong / Matteo Paloni / Loïc Grandvuillemin / Savannah Sirounian / Aurélie Ancelin / Josephine Lai-Kee-Him / Marina Grimaldi / Coralie Carivenc / Claudia Lancey / Timothy J Ragan / ...著者: Hok-Sau Kwong / Matteo Paloni / Loïc Grandvuillemin / Savannah Sirounian / Aurélie Ancelin / Josephine Lai-Kee-Him / Marina Grimaldi / Coralie Carivenc / Claudia Lancey / Timothy J Ragan / Emma L Hesketh / Patrick Balaguer / Alessandro Barducci / Jakub Gruszczyk / William Bourguet /   要旨: The aryl hydrocarbon receptor (AHR) is a ligand-dependent transcription factor belonging to the bHLH/PAS protein family and responding to hundreds of natural and chemical substances. It is primarily ...The aryl hydrocarbon receptor (AHR) is a ligand-dependent transcription factor belonging to the bHLH/PAS protein family and responding to hundreds of natural and chemical substances. It is primarily involved in the defense against chemical insults and bacterial infections or in the adaptive immune response, but also in the development of pathological conditions ranging from inflammatory to neoplastic disorders. Despite its prominent roles in many (patho)physiological processes, the lack of high-resolution structural data has precluded for thirty years an in-depth understanding of the structural mechanisms underlying ligand-binding specificity, promiscuity and activation of AHR. We recently reported a cryogenic electron microscopy (cryo-EM) structure of human AHR bound to the natural ligand indirubin, the chaperone Hsp90 and the co-chaperone XAP2 that provided the first experimental visualization of its ligand-binding PAS-B domain. Here, we report a 2.75 Å resolution structure of the AHR complex bound to the environmental pollutant benzo[a]pyrene (B[a]P). The structure substantiates the existence of a bipartite PAS-B ligand-binding pocket with a geometrically constrained primary binding site controlling ligand binding specificity and affinity, and a secondary binding site contributing to the binding promiscuity of AHR. We also report a docking study of B[a]P congeners that validates the B[a]P-bound PAS-B structure as a suitable model for accurate computational ligand binding assessment. Finally, comparison of our agonist-bound complex with the recently reported structures of mouse and fruit fly AHR PAS-B in different activation states suggests a ligand-induced loop conformational change potentially involved in the regulation of AHR function. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8qmo.cif.gz 8qmo.cif.gz | 646.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8qmo.ent.gz pdb8qmo.ent.gz | 533.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8qmo.json.gz 8qmo.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qm/8qmo https://data.pdbj.org/pub/pdb/validation_reports/qm/8qmo ftp://data.pdbj.org/pub/pdb/validation_reports/qm/8qmo ftp://data.pdbj.org/pub/pdb/validation_reports/qm/8qmo | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | 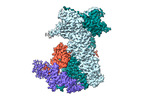 18498MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 3種, 4分子 ABCD
| #1: タンパク質 |  Heat shock response / HSP 90 / Heat shock 84 kDa / HSP 84 / HSP84 Heat shock response / HSP 90 / Heat shock 84 kDa / HSP 84 / HSP84分子量: 84213.141 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: HSP90AB1, HSP90B, HSPC2, HSPCB Homo sapiens (ヒト) / 遺伝子: HSP90AB1, HSP90B, HSPC2, HSPCB発現宿主:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ)参照: UniProt: P08238 #2: タンパク質 | |  / AIP / Aryl-hydrocarbon receptor-interacting protein / HBV X-associated protein 2 / XAP-2 / ...AIP / Aryl-hydrocarbon receptor-interacting protein / HBV X-associated protein 2 / XAP-2 / Immunophilin homolog ARA9 / AIP / Aryl-hydrocarbon receptor-interacting protein / HBV X-associated protein 2 / XAP-2 / ...AIP / Aryl-hydrocarbon receptor-interacting protein / HBV X-associated protein 2 / XAP-2 / Immunophilin homolog ARA9分子量: 37691.047 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: AIP, XAP2 Homo sapiens (ヒト) / 遺伝子: AIP, XAP2発現宿主:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ)参照: UniProt: O00170 #3: タンパク質 | |  芳香族炭化水素受容体 芳香族炭化水素受容体分子量: 49492.559 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: AHR Homo sapiens (ヒト) / 遺伝子: AHR発現宿主:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ)参照: UniProt: P35869 |
|---|
-非ポリマー , 4種, 7分子 





| #4: 化合物 |  モリブデン酸塩 モリブデン酸塩#5: 化合物 |  アデノシン二リン酸 アデノシン二リン酸#6: 化合物 | #7: 化合物 | ChemComp-W62 / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Benzo[a]pyrene-bound Hsp90-XAP2-AHR complex / タイプ: COMPLEX / Entity ID: #1-#3 / 由来: RECOMBINANT | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.254 MDa / 実験値: NO | |||||||||||||||||||||||||||||||||||
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||||||||||||||||
| 由来(組換発現) | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) | |||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7 | |||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||||||||||||
| 試料 | 濃度: 0.18 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES | |||||||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: C-flat-1.2/1.3 | |||||||||||||||||||||||||||||||||||
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 298 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 2300 nm / 最小 デフォーカス(公称値): 800 nm / Cs Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 2300 nm / 最小 デフォーカス(公称値): 800 nm / Cs : 2.7 mm / C2レンズ絞り径: 100 µm / アライメント法: COMA FREE : 2.7 mm / C2レンズ絞り径: 100 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 2 sec. / 電子線照射量: 1.1 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 9849 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING ONLY | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 6327916 | ||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 2.76 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 630113 / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 7ZUB Accession code: 7ZUB / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj
































