+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8faz | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the human BCDX2 complex | ||||||||||||||||||||||||||||||
 要素 要素 |
| ||||||||||||||||||||||||||||||
 キーワード キーワード |  RECOMBINATION (遺伝的組換え) / RECOMBINATION (遺伝的組換え) /  DNA binding protein (DNA結合タンパク質) / ATP binding domain / DNA binding protein (DNA結合タンパク質) / ATP binding domain /  homologous recombination (相同組換え) / RAD51 paralog homologous recombination (相同組換え) / RAD51 paralog | ||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報meiotic DNA recombinase assembly / Rad51C-XRCC3 complex / Rad51B-Rad51C-Rad51D-XRCC2 complex / female meiosis sister chromatid cohesion / blastocyst growth / crossover junction DNA endonuclease activity / somite development / DNA strand invasion / telomere maintenance via recombination / Impaired BRCA2 binding to PALB2 ...meiotic DNA recombinase assembly / Rad51C-XRCC3 complex / Rad51B-Rad51C-Rad51D-XRCC2 complex / female meiosis sister chromatid cohesion / blastocyst growth / crossover junction DNA endonuclease activity / somite development / DNA strand invasion / telomere maintenance via recombination / Impaired BRCA2 binding to PALB2 / gamma-tubulin binding / reciprocal meiotic recombination / regulation of fibroblast apoptotic process / sister chromatid cohesion /  centrosome cycle / Defective homologous recombination repair (HRR) due to BRCA1 loss of function / Defective HDR through Homologous Recombination Repair (HRR) due to PALB2 loss of BRCA1 binding function / Defective HDR through Homologous Recombination Repair (HRR) due to PALB2 loss of BRCA2/RAD51/RAD51C binding function / Homologous DNA Pairing and Strand Exchange / Resolution of D-loop Structures through Synthesis-Dependent Strand Annealing (SDSA) / Resolution of D-loop Structures through Holliday Junction Intermediates / positive regulation of neurogenesis / ATP-dependent DNA damage sensor activity / male meiosis I / Presynaptic phase of homologous DNA pairing and strand exchange / response to X-ray / ATP-dependent activity, acting on DNA / interstrand cross-link repair / centrosome cycle / Defective homologous recombination repair (HRR) due to BRCA1 loss of function / Defective HDR through Homologous Recombination Repair (HRR) due to PALB2 loss of BRCA1 binding function / Defective HDR through Homologous Recombination Repair (HRR) due to PALB2 loss of BRCA2/RAD51/RAD51C binding function / Homologous DNA Pairing and Strand Exchange / Resolution of D-loop Structures through Synthesis-Dependent Strand Annealing (SDSA) / Resolution of D-loop Structures through Holliday Junction Intermediates / positive regulation of neurogenesis / ATP-dependent DNA damage sensor activity / male meiosis I / Presynaptic phase of homologous DNA pairing and strand exchange / response to X-ray / ATP-dependent activity, acting on DNA / interstrand cross-link repair /  somitogenesis / positive regulation of G2/M transition of mitotic cell cycle / somitogenesis / positive regulation of G2/M transition of mitotic cell cycle /  telomere maintenance / telomere maintenance /  神経発生 / meiotic cell cycle / 神経発生 / meiotic cell cycle /  DNA複製 / TP53 Regulates Transcription of DNA Repair Genes / response to gamma radiation / double-strand break repair via homologous recombination / multicellular organism growth / HDR through Homologous Recombination (HRR) / DNA複製 / TP53 Regulates Transcription of DNA Repair Genes / response to gamma radiation / double-strand break repair via homologous recombination / multicellular organism growth / HDR through Homologous Recombination (HRR) /  遺伝的組換え / 遺伝的組換え /  single-stranded DNA binding / mitotic cell cycle / single-stranded DNA binding / mitotic cell cycle /  細胞結合 / Factors involved in megakaryocyte development and platelet production / 細胞結合 / Factors involved in megakaryocyte development and platelet production /  double-stranded DNA binding / double-stranded DNA binding /  精子形成 / DNA recombination / in utero embryonic development / negative regulation of neuron apoptotic process / 精子形成 / DNA recombination / in utero embryonic development / negative regulation of neuron apoptotic process /  chromosome, telomeric region / chromosome, telomeric region /  regulation of cell cycle / intracellular membrane-bounded organelle / regulation of cell cycle / intracellular membrane-bounded organelle /  DNA修復 / DNA修復 /  中心体 / positive regulation of cell population proliferation / perinuclear region of cytoplasm / 中心体 / positive regulation of cell population proliferation / perinuclear region of cytoplasm /  ATP hydrolysis activity / ATP hydrolysis activity /  ミトコンドリア / ミトコンドリア /  DNA binding / DNA binding /  核質 / 核質 /  ATP binding / ATP binding /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||||||||||||||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||||||||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.3 Å クライオ電子顕微鏡法 / 解像度: 2.3 Å | ||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Jia, L. / Wasmuth, E.V. / Ruben, E.A. / Sung, P. / Rawal, Y. / Greene, E.C. / Meir, A. / Olsen, S.K. | ||||||||||||||||||||||||||||||
| 資金援助 |  米国, 9件 米国, 9件
| ||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: Structural insights into BCDX2 complex function in homologous recombination. 著者: Yashpal Rawal / Lijia Jia / Aviv Meir / Shuo Zhou / Hardeep Kaur / Eliza A Ruben / Youngho Kwon / Kara A Bernstein / Maria Jasin / Alexander B Taylor / Sandeep Burma / Robert Hromas / ...著者: Yashpal Rawal / Lijia Jia / Aviv Meir / Shuo Zhou / Hardeep Kaur / Eliza A Ruben / Youngho Kwon / Kara A Bernstein / Maria Jasin / Alexander B Taylor / Sandeep Burma / Robert Hromas / Alexander V Mazin / Weixing Zhao / Daohong Zhou / Elizabeth V Wasmuth / Eric C Greene / Patrick Sung / Shaun K Olsen /  要旨: Homologous recombination (HR) fulfils a pivotal role in the repair of DNA double-strand breaks and collapsed replication forks. HR depends on the products of several paralogues of RAD51, including ...Homologous recombination (HR) fulfils a pivotal role in the repair of DNA double-strand breaks and collapsed replication forks. HR depends on the products of several paralogues of RAD51, including the tetrameric complex of RAD51B, RAD51C, RAD51D and XRCC2 (BCDX2). BCDX2 functions as a mediator of nucleoprotein filament assembly by RAD51 and single-stranded DNA (ssDNA) during HR, but its mechanism remains undefined. Here we report cryogenic electron microscopy reconstructions of human BCDX2 in apo and ssDNA-bound states. The structures reveal how the amino-terminal domains of RAD51B, RAD51C and RAD51D participate in inter-subunit interactions that underpin complex formation and ssDNA-binding specificity. Single-molecule DNA curtain analysis yields insights into how BCDX2 enhances RAD51-ssDNA nucleoprotein filament assembly. Moreover, our cryogenic electron microscopy and functional analyses explain how RAD51C alterations found in patients with cancer inactivate DNA binding and the HR mediator activity of BCDX2. Our findings shed light on the role of BCDX2 in HR and provide a foundation for understanding how pathogenic alterations in BCDX2 impact genome repair. | ||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8faz.cif.gz 8faz.cif.gz | 198.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8faz.ent.gz pdb8faz.ent.gz | 153 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8faz.json.gz 8faz.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/fa/8faz https://data.pdbj.org/pub/pdb/validation_reports/fa/8faz ftp://data.pdbj.org/pub/pdb/validation_reports/fa/8faz ftp://data.pdbj.org/pub/pdb/validation_reports/fa/8faz | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | 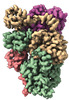 28961MC  8gbjC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-DNA repair protein RAD51 homolog ... , 3種, 3分子 BCD
| #1: タンパク質 |  DNA修復 / R51H2 / RAD51 homolog B / Rad51B / RAD51-like protein 1 DNA修復 / R51H2 / RAD51 homolog B / Rad51B / RAD51-like protein 1分子量: 39125.855 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: RAD51B, RAD51L1, REC2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: RAD51B, RAD51L1, REC2 / 発現宿主:   Trichoplusia ni (イラクサキンウワバ) / Variant (発現宿主): BTI-Tn-5B1-4 / 参照: UniProt: O15315 Trichoplusia ni (イラクサキンウワバ) / Variant (発現宿主): BTI-Tn-5B1-4 / 参照: UniProt: O15315 |
|---|---|
| #2: タンパク質 |  DNA修復 / R51H3 / RAD51 homolog C / RAD51-like protein 2 DNA修復 / R51H3 / RAD51 homolog C / RAD51-like protein 2分子量: 42244.609 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: RAD51C, RAD51L2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: RAD51C, RAD51L2 / 発現宿主:   Trichoplusia ni (イラクサキンウワバ) / Variant (発現宿主): BTI-Tn-5B1-4 / 参照: UniProt: O43502 Trichoplusia ni (イラクサキンウワバ) / Variant (発現宿主): BTI-Tn-5B1-4 / 参照: UniProt: O43502 |
| #3: タンパク質 |  DNA修復 / R51H3 / RAD51 homolog D / RAD51-like protein 3 / TRAD DNA修復 / R51H3 / RAD51 homolog D / RAD51-like protein 3 / TRAD分子量: 35084.254 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: RAD51D, RAD51L3 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: RAD51D, RAD51L3 / 発現宿主:   Trichoplusia ni (イラクサキンウワバ) / Variant (発現宿主): BTI-Tn-5B1-4 / 参照: UniProt: O75771 Trichoplusia ni (イラクサキンウワバ) / Variant (発現宿主): BTI-Tn-5B1-4 / 参照: UniProt: O75771 |
-タンパク質 , 1種, 1分子 X
| #4: タンパク質 |  DNA修復 / X-ray repair cross-complementing protein 2 DNA修復 / X-ray repair cross-complementing protein 2分子量: 32992.488 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: XRCC2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: XRCC2 / 発現宿主:   Trichoplusia ni (イラクサキンウワバ) / Variant (発現宿主): BTI-Tn-5B1-4 / 参照: UniProt: O43543 Trichoplusia ni (イラクサキンウワバ) / Variant (発現宿主): BTI-Tn-5B1-4 / 参照: UniProt: O43543 |
|---|
-非ポリマー , 3種, 5分子 




| #5: 化合物 | ChemComp-ADP /  アデノシン二リン酸 アデノシン二リン酸 | ||
|---|---|---|---|
| #6: 化合物 | | #7: 化合物 | |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Cryo-EM structure of the human heterotetrameric BCDX2 complex タイプ: COMPLEX / Entity ID: #1-#4 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:   Trichoplusia ni (イラクサキンウワバ) / 株: High Five (BTI-TN-5B1-4) Trichoplusia ni (イラクサキンウワバ) / 株: High Five (BTI-TN-5B1-4) |
| 緩衝液 | pH: 7.5 |
| 試料 | 濃度: 0.9 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: TFS GLACIOS |
|---|---|
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 800 nm / Cs Bright-field microscopy / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 800 nm / Cs : 2.7 mm / C2レンズ絞り径: 50 µm : 2.7 mm / C2レンズ絞り径: 50 µm |
| 撮影 | 電子線照射量: 51 e/Å2 フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
3次元再構成 | 解像度: 2.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 489073 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj





















