+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4d2q | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Negative-stain electron microscopy of E. coli ClpB mutant E432A (BAP form bound to ClpP) | ||||||
 要素 要素 | CLPB | ||||||
 キーワード キーワード |  CHAPERONE (シャペロン) / DISAGGREGASE / CHAPERONE (シャペロン) / DISAGGREGASE /  CLPB / BAP / CLPB / BAP /  COILED-COIL DOMAIN (コイルドコイル) COILED-COIL DOMAIN (コイルドコイル) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cellular response to heat / response to heat / protein refolding /  ATP hydrolysis activity / ATP hydrolysis activity /  ATP binding / ATP binding /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   ESCHERICHIA COLI (大腸菌) ESCHERICHIA COLI (大腸菌) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  ネガティブ染色法 / 解像度: 18 Å ネガティブ染色法 / 解像度: 18 Å | ||||||
 データ登録者 データ登録者 | Carroni, M. / Kummer, E. / Oguchi, Y. / Clare, D.K. / Wendler, P. / Sinning, I. / Kopp, J. / Mogk, A. / Bukau, B. / Saibil, H.R. | ||||||
 引用 引用 |  ジャーナル: Elife / 年: 2014 ジャーナル: Elife / 年: 2014タイトル: Head-to-tail interactions of the coiled-coil domains regulate ClpB activity and cooperation with Hsp70 in protein disaggregation. 著者: Marta Carroni / Eva Kummer / Yuki Oguchi / Petra Wendler / Daniel K Clare / Irmgard Sinning / Jürgen Kopp / Axel Mogk / Bernd Bukau / Helen R Saibil /   要旨: The hexameric AAA+ chaperone ClpB reactivates aggregated proteins in cooperation with the Hsp70 system. Essential for disaggregation, the ClpB middle domain (MD) is a coiled-coil propeller that binds ...The hexameric AAA+ chaperone ClpB reactivates aggregated proteins in cooperation with the Hsp70 system. Essential for disaggregation, the ClpB middle domain (MD) is a coiled-coil propeller that binds Hsp70. Although the ClpB subunit structure is known, positioning of the MD in the hexamer and its mechanism of action are unclear. We obtained electron microscopy (EM) structures of the BAP variant of ClpB that binds the protease ClpP, clearly revealing MD density on the surface of the ClpB ring. Mutant analysis and asymmetric reconstructions show that MDs adopt diverse positions in a single ClpB hexamer. Adjacent, horizontally oriented MDs form head-to-tail contacts and repress ClpB activity by preventing Hsp70 interaction. Tilting of the MD breaks this contact, allowing Hsp70 binding, and releasing the contact in adjacent subunits. Our data suggest a wavelike activation of ClpB subunits around the ring.DOI: http://dx.doi.org/10.7554/eLife.02481.001. | ||||||
| 履歴 |
| ||||||
| Remark 650 | HELIX DETERMINATION METHOD: AUTHOR PROVIDED. | ||||||
| Remark 700 | SHEET DETERMINATION METHOD: AUTHOR PROVIDED. |
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4d2q.cif.gz 4d2q.cif.gz | 571.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4d2q.ent.gz pdb4d2q.ent.gz | 336.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4d2q.json.gz 4d2q.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/d2/4d2q https://data.pdbj.org/pub/pdb/validation_reports/d2/4d2q ftp://data.pdbj.org/pub/pdb/validation_reports/d2/4d2q ftp://data.pdbj.org/pub/pdb/validation_reports/d2/4d2q | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  2555MC  2556C  2557C  2558C 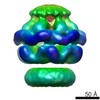 2559C 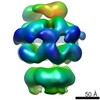 2560C  2561C  2562C  2563C  4ciuC  4d2uC  4d2xC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 |  分子量: 96835.086 Da / 分子数: 6 / 由来タイプ: 組換発現 / 詳細: THE PROTEIN IS ENGINEERED TO BIND TO CLPP. / 由来: (組換発現)   ESCHERICHIA COLI (大腸菌) / プラスミド: PDS56 / 発現宿主: ESCHERICHIA COLI (大腸菌) / プラスミド: PDS56 / 発現宿主:   ESCHERICHIA COLI (大腸菌) / 株 (発現宿主): MC4100 / 参照: UniProt: P63284 ESCHERICHIA COLI (大腸菌) / 株 (発現宿主): MC4100 / 参照: UniProt: P63284 |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: BAP FORM OF CLPB E432A REPRESSED MUTANT WITH ATPGS / タイプ: COMPLEX |
|---|---|
| 緩衝液 | pH: 7.5 |
| 試料 | 濃度: 0.03 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : YES / 凍結 : YES / 凍結 : NO : NO |
| 染色 | タイプ: NEGATIVE / 染色剤: uranyl acetate |
| 試料支持 | 詳細: CARBON |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TECNAI F20 / 日付: 2011年6月6日 |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 50000 X / 倍率(補正後): 68000 X / 最大 デフォーカス(公称値): 1200 nm / 最小 デフォーカス(公称値): 500 nm / Cs Bright-field microscopy / 倍率(公称値): 50000 X / 倍率(補正後): 68000 X / 最大 デフォーカス(公称値): 1200 nm / 最小 デフォーカス(公称値): 500 nm / Cs : 2 mm : 2 mm |
| 撮影 | 電子線照射量: 20 e/Å2 / フィルム・検出器のモデル: GATAN K2 (4k x 4k) |
| 画像スキャン | デジタル画像の数: 110 |
| 放射波長 | 相対比: 1 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | 詳細: PHASE FLIPPING ENTIRE FRAME | ||||||||||||
| 対称性 | 点対称性 : C6 (6回回転対称 : C6 (6回回転対称 ) ) | ||||||||||||
3次元再構成 | 手法: ANGULAR RECONSTITUTION AND PROJECTION MATCHING / 解像度: 18 Å / 粒子像の数: 11570 詳細: SUBMISSION BASED ON EXPERIMENTAL DATA FROM EMDB EMD-2555. (DEPOSITION ID: 12235). 対称性のタイプ: POINT | ||||||||||||
| 精密化 | 最高解像度: 18 Å | ||||||||||||
| 精密化ステップ | サイクル: LAST / 最高解像度: 18 Å
|
 ムービー
ムービー コントローラー
コントローラー









 PDBj
PDBj



