+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-31491 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the C-terminal deletion mutant of human PANX1 in a nanodisc | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Electric Transmission Across Gap Junctions /  leak channel activity / positive regulation of interleukin-1 alpha production / bleb / wide pore channel activity / gap junction channel activity / leak channel activity / positive regulation of interleukin-1 alpha production / bleb / wide pore channel activity / gap junction channel activity /  ギャップ結合 / positive regulation of macrophage cytokine production / ギャップ結合 / positive regulation of macrophage cytokine production /  oogenesis / response to ATP ...Electric Transmission Across Gap Junctions / oogenesis / response to ATP ...Electric Transmission Across Gap Junctions /  leak channel activity / positive regulation of interleukin-1 alpha production / bleb / wide pore channel activity / gap junction channel activity / leak channel activity / positive regulation of interleukin-1 alpha production / bleb / wide pore channel activity / gap junction channel activity /  ギャップ結合 / positive regulation of macrophage cytokine production / ギャップ結合 / positive regulation of macrophage cytokine production /  oogenesis / response to ATP / monoatomic cation transport / The NLRP3 inflammasome / positive regulation of interleukin-1 beta production / response to ischemia / oogenesis / response to ATP / monoatomic cation transport / The NLRP3 inflammasome / positive regulation of interleukin-1 beta production / response to ischemia /  calcium channel activity / calcium ion transport / calcium channel activity / calcium ion transport /  actin filament binding / cell-cell signaling / actin filament binding / cell-cell signaling /  scaffold protein binding / scaffold protein binding /  protease binding / transmembrane transporter binding / protease binding / transmembrane transporter binding /  signaling receptor binding / endoplasmic reticulum membrane / structural molecule activity / signaling receptor binding / endoplasmic reticulum membrane / structural molecule activity /  小胞体 / protein-containing complex / 小胞体 / protein-containing complex /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞膜 細胞膜類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.6 Å クライオ電子顕微鏡法 / 解像度: 3.6 Å | ||||||||||||
 データ登録者 データ登録者 | Kuzuya M / Hirano H / Hayashida K / Watanabe M / Kobayashi K / Tani K / Fujiyoshi Y / Oshima A | ||||||||||||
| 資金援助 |  日本, 3件 日本, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Sci Signal / 年: 2022 ジャーナル: Sci Signal / 年: 2022タイトル: Structures of human pannexin-1 in nanodiscs reveal gating mediated by dynamic movement of the N terminus and phospholipids. 著者: Maki Kuzuya / Hidemi Hirano / Kenichi Hayashida / Masakatsu Watanabe / Kazumi Kobayashi / Tohru Terada / Md Iqbal Mahmood / Florence Tama / Kazutoshi Tani / Yoshinori Fujiyoshi / Atsunori Oshima /  要旨: Pannexin (PANX) family proteins form large-pore channels that mediate purinergic signaling. We analyzed the cryo-EM structures of human PANX1 in lipid nanodiscs to elucidate the gating mechanism and ...Pannexin (PANX) family proteins form large-pore channels that mediate purinergic signaling. We analyzed the cryo-EM structures of human PANX1 in lipid nanodiscs to elucidate the gating mechanism and its regulation by the amino terminus in phospholipids. The wild-type channel has an amino-terminal funnel in the pore, but in the presence of the inhibitor probenecid, a cytoplasmically oriented amino terminus and phospholipids obstruct the pore. Functional analysis using whole-cell patch-clamp and oocyte voltage clamp showed that PANX1 lacking the amino terminus did not open and had a dominant negative effect on channel activity, thus confirming that the amino-terminal domain played an essential role in channel opening. These observations suggest that dynamic conformational changes in the amino terminus of human PANX1 are associated with lipid movement in and out of the pore. Moreover, the data provide insight into the gating mechanism of PANX1 and, more broadly, other large-pore channels. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_31491.map.gz emd_31491.map.gz | 12.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-31491-v30.xml emd-31491-v30.xml emd-31491.xml emd-31491.xml | 18.9 KB 18.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_31491_fsc.xml emd_31491_fsc.xml | 10 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_31491.png emd_31491.png | 227.2 KB | ||
| マスクデータ |  emd_31491_msk_1.map emd_31491_msk_1.map | 83.7 MB |  マスクマップ マスクマップ | |
| その他 |  emd_31491_half_map_1.map.gz emd_31491_half_map_1.map.gz emd_31491_half_map_2.map.gz emd_31491_half_map_2.map.gz | 65.5 MB 65.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-31491 http://ftp.pdbj.org/pub/emdb/structures/EMD-31491 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-31491 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-31491 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7f8oMC  7f8jC  7f8nC  7wsvC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10759 (タイトル: Structure of C-terminal deleted human pannexin-1 in nanodisc EMPIAR-10759 (タイトル: Structure of C-terminal deleted human pannexin-1 in nanodiscData size: 784.4 Data #1: C-terminal deletion mutant of human PANX1 in nanodisc [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_31491.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_31491.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.81 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_31491_msk_1.map emd_31491_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
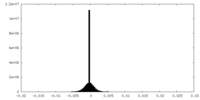
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_31491_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
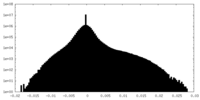
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_31491_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
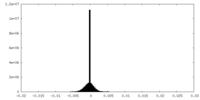
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : heptamar of human pannexin-1 channel in a nanodisc
| 全体 | 名称: heptamar of human pannexin-1 channel in a nanodisc |
|---|---|
| 要素 |
|
-超分子 #1: heptamar of human pannexin-1 channel in a nanodisc
| 超分子 | 名称: heptamar of human pannexin-1 channel in a nanodisc / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Pannexin-1
| 分子 | 名称: Pannexin-1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 7 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 48.093863 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MAIAQLATEY VFSDFLLKEP TEPKFKGLRL ELAVDKMVTC IAVGLPLLLI SLAFAQEISI GTQISCFSPS SFSWRQAAFV DSYCWAAVQ QKNSLQSESG NLPLWLHKFF PYILLLFAIL LYLPPLFWRF AAAPHICSDL KFIMEELDKV YNRAIKAAKS A RDLDMRDG ...文字列: MAIAQLATEY VFSDFLLKEP TEPKFKGLRL ELAVDKMVTC IAVGLPLLLI SLAFAQEISI GTQISCFSPS SFSWRQAAFV DSYCWAAVQ QKNSLQSESG NLPLWLHKFF PYILLLFAIL LYLPPLFWRF AAAPHICSDL KFIMEELDKV YNRAIKAAKS A RDLDMRDG ACSVPGVTEN LGQSLWEVSE SHFKYPIVEQ YLKTKKNSNN LIIKYISCRL LTLIIILLAC IYLGYYFSLS SL SDEFVCS IKSGILRNDS TVPDQFQCKL IAVGIFQLLS VINLVVYVLL APVVVYTLFV PFRQKTDVLK VYEILPTFDV LHF KSEGYN DLSLYNLFLE ENISEVKSYK CLKVLENIKS SGQGIDPMLL LTNLGMIKMD VVDGKTPMSA EMREEQGNQT AELQ GMNID SETKANNGEK NARQRLLDSS C |
-分子 #2: 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine
| 分子 | 名称: 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine / タイプ: ligand / ID: 2 / コピー数: 21 / 式: LBN |
|---|---|
| 分子量 | 理論値: 760.076 Da |
| Chemical component information |  ChemComp-LBN: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4.8 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: MOLYBDENUM / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE | |||||||||
| 凍結 | 凍結剤: ETHANE / 装置: LEICA KF80 詳細: blot for 10 seconds at room temperature followed by plunge freezing. Because of manual blotting, humidity and temperature in a room is not controlled.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL CRYO ARM 300 |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 最大 デフォーカス(補正後): 5.0 µm / 最小 デフォーカス(補正後): 0.5 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 倍率(公称値): 40000 Bright-field microscopy / Cs: 2.7 mm / 倍率(公称値): 40000 |
| 特殊光学系 | エネルギーフィルター - 名称: In-column Omega Filter エネルギーフィルター - スリット幅: 30 eV |
| 試料ステージ | 試料ホルダーモデル: JEOL / ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 撮影したグリッド数: 1 / 平均露光時間: 2.4 sec. / 平均電子線量: 40.0 e/Å2 |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL / 温度因子: 153.6 |
|---|---|
| 得られたモデル |  PDB-7f8o: |
 ムービー
ムービー コントローラー
コントローラー





















 Z
Z Y
Y X
X