+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | aRML prion fibril | |||||||||
 マップデータ マップデータ | aRML prion EM map | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process /  lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity /  glycosaminoglycan binding / negative regulation of interleukin-17 production / ATP-dependent protein binding / regulation of potassium ion transmembrane transport ...Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process / glycosaminoglycan binding / negative regulation of interleukin-17 production / ATP-dependent protein binding / regulation of potassium ion transmembrane transport ...Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process /  lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity /  glycosaminoglycan binding / negative regulation of interleukin-17 production / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of dendritic spine maintenance / type 5 metabotropic glutamate receptor binding / cupric ion binding / nucleobase-containing compound metabolic process / response to copper ion / negative regulation of calcineurin-NFAT signaling cascade / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / cuprous ion binding / activation of protein kinase activity / negative regulation of amyloid-beta formation / negative regulation of activated T cell proliferation / response to amyloid-beta / : / negative regulation of type II interferon production / intracellular copper ion homeostasis / positive regulation of protein targeting to membrane / negative regulation of long-term synaptic potentiation / response to cadmium ion / side of membrane / glycosaminoglycan binding / negative regulation of interleukin-17 production / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of dendritic spine maintenance / type 5 metabotropic glutamate receptor binding / cupric ion binding / nucleobase-containing compound metabolic process / response to copper ion / negative regulation of calcineurin-NFAT signaling cascade / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / cuprous ion binding / activation of protein kinase activity / negative regulation of amyloid-beta formation / negative regulation of activated T cell proliferation / response to amyloid-beta / : / negative regulation of type II interferon production / intracellular copper ion homeostasis / positive regulation of protein targeting to membrane / negative regulation of long-term synaptic potentiation / response to cadmium ion / side of membrane /  封入体 / regulation of peptidyl-tyrosine phosphorylation / cellular response to copper ion / neuron projection maintenance / molecular condensate scaffold activity / 封入体 / regulation of peptidyl-tyrosine phosphorylation / cellular response to copper ion / neuron projection maintenance / molecular condensate scaffold activity /  tubulin binding / protein sequestering activity / negative regulation of protein phosphorylation / molecular function activator activity / positive regulation of protein localization to plasma membrane / protein destabilization / protein homooligomerization / negative regulation of DNA-binding transcription factor activity / tubulin binding / protein sequestering activity / negative regulation of protein phosphorylation / molecular function activator activity / positive regulation of protein localization to plasma membrane / protein destabilization / protein homooligomerization / negative regulation of DNA-binding transcription factor activity /  terminal bouton / cellular response to amyloid-beta / positive regulation of neuron apoptotic process / terminal bouton / cellular response to amyloid-beta / positive regulation of neuron apoptotic process /  regulation of protein localization / positive regulation of peptidyl-tyrosine phosphorylation / cellular response to xenobiotic stimulus / regulation of protein localization / positive regulation of peptidyl-tyrosine phosphorylation / cellular response to xenobiotic stimulus /  signaling receptor activity / signaling receptor activity /  amyloid-beta binding / protein-folding chaperone binding / amyloid-beta binding / protein-folding chaperone binding /  microtubule binding / microtubule binding /  核膜 / response to oxidative stress / 核膜 / response to oxidative stress /  protease binding / mitochondrial outer membrane / transmembrane transporter binding / protease binding / mitochondrial outer membrane / transmembrane transporter binding /  postsynaptic density / learning or memory / molecular adaptor activity / postsynaptic density / learning or memory / molecular adaptor activity /  脂質ラフト / copper ion binding / intracellular membrane-bounded organelle / 脂質ラフト / copper ion binding / intracellular membrane-bounded organelle /  樹状突起 / protein-containing complex binding / negative regulation of apoptotic process / 樹状突起 / protein-containing complex binding / negative regulation of apoptotic process /  ゴルジ体 / ゴルジ体 /  細胞膜 / 細胞膜 /  小胞体 / 小胞体 /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  metal ion binding / metal ion binding /  細胞膜 / 細胞膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Mus musculus (ハツカネズミ) / Mus musculus (ハツカネズミ) /   house mouse (ハツカネズミ) house mouse (ハツカネズミ) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.0 Å クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||
 データ登録者 データ登録者 | Hoyt F / Standke HG / Artikis E / Caughey B / Kraus A | |||||||||
| 資金援助 | 2件
| |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2021 ジャーナル: Mol Cell / 年: 2021タイトル: High-resolution structure and strain comparison of infectious mammalian prions. 著者: Allison Kraus / Forrest Hoyt / Cindi L Schwartz / Bryan Hansen / Efrosini Artikis / Andrew G Hughson / Gregory J Raymond / Brent Race / Gerald S Baron / Byron Caughey /  要旨: Within the extensive range of self-propagating pathologic protein aggregates of mammals, prions are the most clearly infectious (e.g., ∼10 lethal doses per milligram). The structures of such lethal ...Within the extensive range of self-propagating pathologic protein aggregates of mammals, prions are the most clearly infectious (e.g., ∼10 lethal doses per milligram). The structures of such lethal assemblies of PrP molecules have been poorly understood. Here we report a near-atomic core structure of a brain-derived, fully infectious prion (263K strain). Cryo-electron microscopy showed amyloid fibrils assembled with parallel in-register intermolecular β sheets. Each monomer provides one rung of the ordered fibril core, with N-linked glycans and glycolipid anchors projecting outward. Thus, single monomers form the templating surface for incoming monomers at fibril ends, where prion growth occurs. Comparison to another prion strain (aRML) revealed major differences in fibril morphology but, like 263K, an asymmetric fibril cross-section without paired protofilaments. These findings provide structural insights into prion propagation, strains, species barriers, and membrane pathogenesis. This structure also helps frame considerations of factors influencing the relative transmissibility of other pathologic amyloids. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25824.map.gz emd_25824.map.gz | 152.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25824-v30.xml emd-25824-v30.xml emd-25824.xml emd-25824.xml | 19.4 KB 19.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_25824_fsc.xml emd_25824_fsc.xml | 13.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_25824.png emd_25824.png | 73.8 KB | ||
| その他 |  emd_25824_additional_1.map.gz emd_25824_additional_1.map.gz emd_25824_half_map_1.map.gz emd_25824_half_map_1.map.gz emd_25824_half_map_2.map.gz emd_25824_half_map_2.map.gz | 8.1 MB 153 MB 153 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25824 http://ftp.pdbj.org/pub/emdb/structures/EMD-25824 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25824 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25824 | HTTPS FTP |
-関連構造データ
| 関連構造データ | 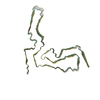 7td6MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25824.map.gz / 形式: CCP4 / 大きさ: 193.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25824.map.gz / 形式: CCP4 / 大きさ: 193.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | aRML prion EM map | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.09 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: aRML prion EM post-processed masked map out of Relion
| ファイル | emd_25824_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | aRML prion EM post-processed masked map out of Relion | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: aRML prion refinement half-map 1
| ファイル | emd_25824_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | aRML prion refinement half-map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: aRML prion refinement half-map 2
| ファイル | emd_25824_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | aRML prion refinement half-map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : aRML prion
| 全体 | 名称: aRML prion |
|---|---|
| 要素 |
|
-超分子 #1: aRML prion
| 超分子 | 名称: aRML prion / タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: all / 詳細: anchorless RML prion fibril |
|---|---|
| 由来(天然) | 生物種:   Mus musculus (ハツカネズミ) / 組織: brain-derived Mus musculus (ハツカネズミ) / 組織: brain-derived |
-分子 #1: Major prion protein
| 分子 | 名称: Major prion protein / タイプ: protein_or_peptide / ID: 1 詳細: proteinase-K resistant aRML prion fibril ordered core encompasses residues 93-230 コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   house mouse (ハツカネズミ) house mouse (ハツカネズミ) |
| 分子量 | 理論値: 28.008393 KDa |
| 配列 | 文字列: MANLGYWLLA LFVTMWTDVG LCKKRPKPGG WNTGGSRYPG QGSPGGNRYP PQGGTWGQPH GGGWGQPHGG SWGQPHGGSW GQPHGGGWG QGGGTHNQWN KPSKPKTNLK HVAGAAAAGA VVGGLGGYML GSAMSRPMIH FGNDWEDRYY RENMYRYPNQ V YYRPVDQY ...文字列: MANLGYWLLA LFVTMWTDVG LCKKRPKPGG WNTGGSRYPG QGSPGGNRYP PQGGTWGQPH GGGWGQPHGG SWGQPHGGSW GQPHGGGWG QGGGTHNQWN KPSKPKTNLK HVAGAAAAGA VVGGLGGYML GSAMSRPMIH FGNDWEDRYY RENMYRYPNQ V YYRPVDQY SNQNNFVHDC VNITIKQHTV TTTTKGENFT ETDVKMMERV VEQMCVTQYQ KESQAYYDGR RSSSTVLFSS PP VILLISF LIFLIVG |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 |
| グリッド | モデル: C-flat-1.2/1.3 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE |
| 詳細 | purified aRML prion fibrils |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.7 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 81000 Bright-field microscopy / 最大 デフォーカス(公称値): 2.7 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 60.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー




 Z
Z Y
Y X
X