+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22233 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of ASC-Caspase1 Octamer | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 Pyrin domain binding / NLRP6 inflammasome complex / Pyrin domain binding / NLRP6 inflammasome complex /  myosin I binding / positive regulation of antigen processing and presentation of peptide antigen via MHC class II / myeloid dendritic cell activation involved in immune response / regulation of intrinsic apoptotic signaling pathway / myosin I binding / positive regulation of antigen processing and presentation of peptide antigen via MHC class II / myeloid dendritic cell activation involved in immune response / regulation of intrinsic apoptotic signaling pathway /  カスパーゼ-1 / カスパーゼ-1 /  protease inhibitor complex / myeloid dendritic cell activation / protease inhibitor complex / myeloid dendritic cell activation /  IkappaB kinase complex ... IkappaB kinase complex ... Pyrin domain binding / NLRP6 inflammasome complex / Pyrin domain binding / NLRP6 inflammasome complex /  myosin I binding / positive regulation of antigen processing and presentation of peptide antigen via MHC class II / myeloid dendritic cell activation involved in immune response / regulation of intrinsic apoptotic signaling pathway / myosin I binding / positive regulation of antigen processing and presentation of peptide antigen via MHC class II / myeloid dendritic cell activation involved in immune response / regulation of intrinsic apoptotic signaling pathway /  カスパーゼ-1 / カスパーゼ-1 /  protease inhibitor complex / myeloid dendritic cell activation / protease inhibitor complex / myeloid dendritic cell activation /  IkappaB kinase complex / AIM2 inflammasome complex assembly / The AIM2 inflammasome / AIM2 inflammasome complex / IkappaB kinase complex / AIM2 inflammasome complex assembly / The AIM2 inflammasome / AIM2 inflammasome complex /  飲作用 / IPAF inflammasome complex / The IPAF inflammasome / NLRP1 inflammasome complex / 飲作用 / IPAF inflammasome complex / The IPAF inflammasome / NLRP1 inflammasome complex /  interleukin-6 receptor binding / icosanoid biosynthetic process / cytokine precursor processing / NLRP3 inflammasome complex assembly / canonical inflammasome complex / positive regulation of adaptive immune response / positive regulation of interleukin-18 production / BMP receptor binding / interleukin-6 receptor binding / icosanoid biosynthetic process / cytokine precursor processing / NLRP3 inflammasome complex assembly / canonical inflammasome complex / positive regulation of adaptive immune response / positive regulation of interleukin-18 production / BMP receptor binding /  NLRP3 inflammasome complex / NLRP3 inflammasome complex /  caspase binding / caspase binding /  CARD domain binding / osmosensory signaling pathway / negative regulation of protein serine/threonine kinase activity / negative regulation of interferon-beta production / CLEC7A/inflammasome pathway / positive regulation of tumor necrosis factor-mediated signaling pathway / positive regulation of cysteine-type endopeptidase activity / regulation of tumor necrosis factor-mediated signaling pathway / Interleukin-1 processing / Interleukin-37 signaling / positive regulation of extrinsic apoptotic signaling pathway / positive regulation of macrophage cytokine production / pattern recognition receptor signaling pathway / cellular response to organic substance / CARD domain binding / osmosensory signaling pathway / negative regulation of protein serine/threonine kinase activity / negative regulation of interferon-beta production / CLEC7A/inflammasome pathway / positive regulation of tumor necrosis factor-mediated signaling pathway / positive regulation of cysteine-type endopeptidase activity / regulation of tumor necrosis factor-mediated signaling pathway / Interleukin-1 processing / Interleukin-37 signaling / positive regulation of extrinsic apoptotic signaling pathway / positive regulation of macrophage cytokine production / pattern recognition receptor signaling pathway / cellular response to organic substance /  tropomyosin binding / positive regulation of actin filament polymerization / negative regulation of NF-kappaB transcription factor activity / positive regulation of activated T cell proliferation / signaling receptor ligand precursor processing / TP53 Regulates Transcription of Caspase Activators and Caspases / pyroptotic inflammatory response / cysteine-type endopeptidase activator activity involved in apoptotic process / positive regulation of release of cytochrome c from mitochondria / positive regulation of interleukin-10 production / positive regulation of cysteine-type endopeptidase activity involved in apoptotic process / protein maturation / The NLRP3 inflammasome / protein autoprocessing / intrinsic apoptotic signaling pathway by p53 class mediator / intrinsic apoptotic signaling pathway in response to DNA damage by p53 class mediator / negative regulation of cytokine production involved in inflammatory response / positive regulation of T cell migration / tropomyosin binding / positive regulation of actin filament polymerization / negative regulation of NF-kappaB transcription factor activity / positive regulation of activated T cell proliferation / signaling receptor ligand precursor processing / TP53 Regulates Transcription of Caspase Activators and Caspases / pyroptotic inflammatory response / cysteine-type endopeptidase activator activity involved in apoptotic process / positive regulation of release of cytochrome c from mitochondria / positive regulation of interleukin-10 production / positive regulation of cysteine-type endopeptidase activity involved in apoptotic process / protein maturation / The NLRP3 inflammasome / protein autoprocessing / intrinsic apoptotic signaling pathway by p53 class mediator / intrinsic apoptotic signaling pathway in response to DNA damage by p53 class mediator / negative regulation of cytokine production involved in inflammatory response / positive regulation of T cell migration /  Pyroptosis / cellular response to interleukin-1 / Pyroptosis / cellular response to interleukin-1 /  Purinergic signaling in leishmaniasis infection / positive regulation of phagocytosis / negative regulation of canonical NF-kappaB signal transduction / positive regulation of chemokine production / positive regulation of defense response to virus by host / tumor necrosis factor-mediated signaling pathway / activation of innate immune response / positive regulation of interleukin-1 beta production / Purinergic signaling in leishmaniasis infection / positive regulation of phagocytosis / negative regulation of canonical NF-kappaB signal transduction / positive regulation of chemokine production / positive regulation of defense response to virus by host / tumor necrosis factor-mediated signaling pathway / activation of innate immune response / positive regulation of interleukin-1 beta production /  regulation of autophagy / positive regulation of interleukin-8 production / positive regulation of JNK cascade / regulation of autophagy / positive regulation of interleukin-8 production / positive regulation of JNK cascade /  regulation of protein stability / NOD1/2 Signaling Pathway / protein homooligomerization / regulation of protein stability / NOD1/2 Signaling Pathway / protein homooligomerization /  kinase binding / positive regulation of inflammatory response / cellular response to type II interferon / positive regulation of interleukin-6 production / positive regulation of non-canonical NF-kappaB signal transduction / cellular response to mechanical stimulus / activation of cysteine-type endopeptidase activity involved in apoptotic process / SARS-CoV-1 activates/modulates innate immune responses / positive regulation of DNA-binding transcription factor activity / azurophil granule lumen / positive regulation of T cell activation / positive regulation of type II interferon production / positive regulation of tumor necrosis factor production / cellular response to tumor necrosis factor / positive regulation of NF-kappaB transcription factor activity / kinase binding / positive regulation of inflammatory response / cellular response to type II interferon / positive regulation of interleukin-6 production / positive regulation of non-canonical NF-kappaB signal transduction / cellular response to mechanical stimulus / activation of cysteine-type endopeptidase activity involved in apoptotic process / SARS-CoV-1 activates/modulates innate immune responses / positive regulation of DNA-binding transcription factor activity / azurophil granule lumen / positive regulation of T cell activation / positive regulation of type II interferon production / positive regulation of tumor necrosis factor production / cellular response to tumor necrosis factor / positive regulation of NF-kappaB transcription factor activity /  regulation of inflammatory response / secretory granule lumen / regulation of apoptotic process / defense response to virus / positive regulation of canonical NF-kappaB signal transduction / regulation of inflammatory response / secretory granule lumen / regulation of apoptotic process / defense response to virus / positive regulation of canonical NF-kappaB signal transduction /  endopeptidase activity / cellular response to lipopolysaccharide / endopeptidase activity / cellular response to lipopolysaccharide /  protease binding / defense response to Gram-negative bacterium / protease binding / defense response to Gram-negative bacterium /  微小管 微小管類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
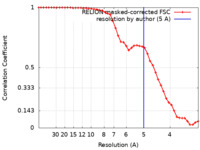
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 5.0 Å クライオ電子顕微鏡法 / 解像度: 5.0 Å | |||||||||
 データ登録者 データ登録者 | Hollingsworth LR / David L / Li Y / Ruan J / Wu H | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Mechanism of filament formation in UPA-promoted CARD8 and NLRP1 inflammasomes. 著者: L Robert Hollingsworth / Liron David / Yang Li / Andrew R Griswold / Jianbin Ruan / Humayun Sharif / Pietro Fontana / Elizabeth L Orth-He / Tian-Min Fu / Daniel A Bachovchin / Hao Wu /  要旨: NLRP1 and CARD8 are related cytosolic sensors that upon activation form supramolecular signalling complexes known as canonical inflammasomes, resulting in caspase-1 activation, cytokine maturation ...NLRP1 and CARD8 are related cytosolic sensors that upon activation form supramolecular signalling complexes known as canonical inflammasomes, resulting in caspase-1 activation, cytokine maturation and/or pyroptotic cell death. NLRP1 and CARD8 use their C-terminal (CT) fragments containing a caspase recruitment domain (CARD) and the UPA (conserved in UNC5, PIDD, and ankyrins) subdomain for self-oligomerization, which in turn form the platform to recruit the inflammasome adaptor ASC (apoptosis-associated speck-like protein containing a CARD) or caspase-1, respectively. Here, we report cryo-EM structures of NLRP1-CT and CARD8-CT assemblies, in which the respective CARDs form central helical filaments that are promoted by oligomerized, but flexibly linked, UPAs surrounding the filaments. Through biochemical and cellular approaches, we demonstrate that the UPA itself reduces the threshold needed for NLRP1-CT and CARD8-CT filament formation and signalling. Structural analyses provide insights on the mode of ASC recruitment by NLRP1-CT and the contrasting direct recruitment of caspase-1 by CARD8-CT. We also discover that subunits in the central NLRP1 filament dimerize with additional exterior CARDs, which roughly doubles its thickness and is unique among all known CARD filaments. Finally, we engineer and determine the structure of an ASC-caspase-1 octamer, which suggests that ASC uses opposing surfaces for NLRP1, versus caspase-1, recruitment. Together these structures capture the architecture and specificity of the active NLRP1 and CARD8 inflammasomes in addition to key heteromeric CARD-CARD interactions governing inflammasome signalling. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22233.map.gz emd_22233.map.gz | 652.2 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22233-v30.xml emd-22233-v30.xml emd-22233.xml emd-22233.xml | 11.5 KB 11.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_22233_fsc.xml emd_22233_fsc.xml | 4.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_22233.png emd_22233.png | 80 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22233 http://ftp.pdbj.org/pub/emdb/structures/EMD-22233 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22233 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22233 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7keuMC  6xkjC  6xkkC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10566 (タイトル: ASC-CARD:Caspase-1-CARD octamer / Data size: 1.2 TB EMPIAR-10566 (タイトル: ASC-CARD:Caspase-1-CARD octamer / Data size: 1.2 TBData #1: Unaligned multi-frame micrographs for the ASC-CASP1 CARD octamer [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22233.map.gz / 形式: CCP4 / 大きさ: 6.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22233.map.gz / 形式: CCP4 / 大きさ: 6.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.65 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Cryo-EM structure of ASC-Caspase1 Octamer
| 全体 | 名称: Cryo-EM structure of ASC-Caspase1 Octamer |
|---|---|
| 要素 |
|
-超分子 #1: Cryo-EM structure of ASC-Caspase1 Octamer
| 超分子 | 名称: Cryo-EM structure of ASC-Caspase1 Octamer / タイプ: complex / ID: 1 / 親要素: 0 詳細: A complex of ASC-CARD tetramer and Caspase1-CARD tetramer |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 分子量 | 実験値: 86.3 KDa |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||
| グリッド | 詳細: unspecified | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm Bright-field microscopy / Cs: 2.7 mm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 1606 / 平均電子線量: 58.0 e/Å2 |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー